Utilisation du PRP dans la gonarthrose : état des lieux des recommandations

Jérémy Magalon
Département de Culture et Thérapie Cellulaire, Hôpital de la Conception, AP-HM, Marseille ; C2VN, INRA, INSERM, Aix Mars...

Hervé Bard
Groupe de Recherche International sur les Injections de Plaquettes ; Rhumatologue, Cabinet médical Vaudoyer, Paris.

Eric Noel
Groupe de Recherche International sur les Injections de Plaquettes ; Rhumatologue et Médecin du Sport, Centre orthopédiq...
Résumé Le Plasma Riche en Plaquettes connaît une utilisation clinique croissante dans les pathologies de l'appareil locomoteur et en particulier dans la gonarthrose. Ce produit biologique autologue fait l'objet de beaucoup de controverses, entre remède miracle aux vertus régénératives pour certains et placebo particulièrement lucratif pour d'autres. Cet article s'attache à faire l'état des lieux des recommandations internationales tant au niveau de l'efficacité de cette procédure que de l'utilisation en pratique courante.
Liens d'intérêt Jérémy Magalon a perçu des honoraires de Fidia, Horiba, Macopharma, Arthrex et Horus Pharma pour des actions de formation. Il est co-fondateur de la société REMEDEX (Réseau de Médecine Régénérative d'Excellence). Hervé Bard a perçu des honoraires de Fidia et RegenLab pour des actions de formation et d'expertise et est président du GRIIP (association loi 1901) qui a perçu des donations provenant de Fidia, Regenlab et Arthrex. Eric Noel n'a pas de conflit d'intérêt. Les fabricants n'ont joué aucun rôle dans l'élaboration de cet article ou sa décision de publication.
Mots clés PRP, plaquettes, gonarthrose, médecine régénérative, recommandations.
Définition du plasma riche en plaquettes (PRP) Le plasma riche en plaquettes (PRP) est un produit biologique autologue défini par une concentration supraphysiologique de plaquettes et contenant des protéines bioactives telles que des facteurs de croissance, des cytokines et des chimiokines.
La première utilisation clinique du PRP est attribuée au Dr Robert Marx, chirurgien maxillo-facial, qui utilise les plaquettes sanguines d'un patient pour améliorer la reconstruction osseuse d'une mandibule. Selon lui, le PRP se définit comme une suspension de plaquettes plasmatiques dont la concentration plaquettaire est supérieure à la concentration du prélèvement sanguin de départ. En s'appuyant sur son expérience clinique, il décrit une amélioration de la cicatrisation osseuse et des tissus mous lors de l'utilisation de 5 mL de PRP concentré à 1 000 G/L, soit une dose de plaquettes injectées de 5 milliards [1]. Le pouvoir régénératif du PRP, même s'il n'est pas complètement élucidé à ce jour, est lié, entre autres, à son contenu en facteurs de croissance plaquettaires. Le terme « facteurs de croissance » regroupe un grand nombre de polypeptides impliqués non seulement dans les phénomènes de croissance cellulaire, mais aussi dans d'autres processus physiologiques importants, notamment dans la cicatrisation. Ces facteurs de croissance en coordonnent les différentes étapes par des interrelations complexes et ce, à des concentrations très faibles, de l'ordre du picogramme [2]. Une plaquette renferme en moyenne 50 à 80 granules ð¶ð¶. Ces derniers constituent le réservoir de plus de 30 protéines bioactives participant à l'essentiel des fonctions plaquettaires [3]. Parmi ces protéines, certains facteurs de croissance suscitent un intérêt particulier du fait de leur participation à la régénération tissulaire [4]. On peut considérer que ce sont ces facteurs, dont les principales fonctions sont détaillées dans le tableau 1, qui constituent le principe actif du PRP.
Préparation du PRP La préparation du PRP repose sur une simple centrifugation d'un tube, d'une seringue ou d'une poche contenant du sang total anticoagulé et prélevé, le plus souvent, au pli du coude. Les éléments figurés du sang (érythrocytes, leucocytes et plaquettes) sont séparés du plasma compte tenu de leur différence de densités. Le PRP est obtenu en récupérant la phase plasmatique et les plaquettes, qui possèdent les densités les plus faibles, puis il est réinjecté au cours de la même consultation ou dans le même temps opératoire. Basé sur le fait que la centrifugation est responsable d'un gradient de plaquettes sur l'ensemble de la phase plasmatique, la partie supérieure du plasma correspond au plasma pauvre en plaquettes (PPP) et la partie inférieure au contact des globules rouges constitue le PRP. Cette affirmation est à pondérer puisque la répartition des plaquettes au sein de la phase plasmatique est dépendante du temps et de la vitesse de centrifugation. Il n'existe à l'heure actuelle pas de consensus sur le nombre, la vitesse et le temps de centrifugation nécessaires pour l'obtention du PRP. D'un point de vue réglementaire, l'absence de noyaux dans les plaquettes explique que la préparation de PRP échappe à la réglementation européenne complexe des produits de thérapie cellulaire ou des médicaments de thérapies innovantes. Ainsi, la préparation de PRP doit être réalisée à l'aide d'un dispositif médical dédié à cet effet et possédant un marquage CE 93/42 (différent du marquage CE IVD 98/79 pour les tubes de laboratoire dont le prélèvement est à visée diagnostique) et l'ensemble des étapes (prélèvement, préparation et injection) doit être réalisé en respectant une unité de lieu. Dans ce contexte, la fabrication et l'injection de PRP sont intégrées à une procédure de soins. La démocratisation et la popularité de cette procédure auprès des patients, en particulier dans le domaine de la médecine du sport, associée à la facilité d'obtention du marquage CE a suscité un engouement massif de la part des fabricants de dispositifs médicaux pour réaliser cette procédure et il existe environ 50 systèmes commerciaux disponibles. La revue exhaustive de la littérature publiée par Magalon et coll. en 2021 a compilé et comparé l'ensemble des données biologiques issues des dispositifs commerciaux et disponibles sur Pubmed [5]. Ainsi, 36 préparations de PRP étaient décrites biologiquement, mais représentaient seulement 14 des 50 dispositifs existants (28 %) puisque certains étaient décrits dans différents articles. Cette revue a confirmé l'hétérogénéité biologique des PRP obtenus à partir de dispositifs différents (pureté plaquettaire variant de 6 à 99,6 % ; rendement plaquettaire variant de 17 à 94 % ; dose de plaquettes obtenues variant de 300 millions à 12 milliards), mais également pour un dispositif donné (dispositifs décrits 4 fois dans la littérature dont la pureté plaquettaire varie de 65 à 92 % ; rendement plaquettaire variant de 49 à 80 % ; dose de plaquettes obtenues variant de 1,3 à 2,5 milliards). Malgré cette hétérogénéité, Chahla et coll. ont rapporté dans une revue de la littérature de plus de 100 études utilisant le PRP que les auteurs décrivaient trop rarement les éléments en lien avec la préparation (10 %) et la composition du PRP (16 %) empêchant toute conclusion solide sur l'efficacité ou non de la procédure puisqu'elle est par définition très hétérogène [6]. C'est ce faisceau d'arguments qui a poussé un groupe d'experts américains menés par le Dr Robert Laprade à publier dans JBJS en 2017 les MIBO pour Minimum Information to provide for studies evaluating Biologics in the Orthopedics field [7], reprises depuis par d'autres sociétés savantes et décrites dans le paragraphe recommandations de ce chapitre.
Recommandations De nombreuses recommandations concernant l'utilisation du PRP dans les affections musculosquelettiques, en particulier l'arthrose du genou, ont été publiées ces dernières années. Elles peuvent être classées en deux types : les recommandations concernant directement son efficacité et celles suggérant des pistes d'amélioration sur son utilisation.
Recommandations - Efficacité clinique Une revue publiée en 2021 par Phillips et coll. s'est penchée sur les différentes recommandations cliniques des produits injectables dans l'arthrose du genou. Les auteurs identifient 11 articles ayant fait l'objet de recommandations de sociétés savantes, mais aucune d'elles n'émet un avis favorable sur l'utilisation du PRP [8]. Celles de l'Osteoarthritis Research Society International (OARSI) et de l'American College of Rheumatology (ACR), publiées respectivement en 2019 [9] et 2020 [10], sont même opposées à son utilisation. Les 9 autres recommandations ne prennent pas position et mettent en avant un faible niveau d'évidencescientifique et une hétérogénéité trop importante des PRP injectés. Parmi les autres recommandations, l'American Academy of Orthopaedic Surgeons a publié en 2022 la 3e édition des recommandations cliniques (Clinical Practice Guideline) sur le traitement non chirurgical de l'arthrose du genou [11]. Cette recommandation repose sur une revue systématique de la littérature avec l'analyse des essais cliniques comparant le PRP aux autres modalités de traitements (médicamenteuses ou non) à l'issue de laquelle un groupe de 14 experts a classé 27 propositions sur un niveau d'évidence sur une échelle de 4 critères (faible, limitée, modéré, fort). Elle conclut que le PRP peut réduire la douleur et améliorer la fonction des patients présentant une arthrose du genou symptomatique avec une évidence classée comme limitée. À titre de comparaison, elle s'est prononcée en faveur des injections de cortisone pour un bénéfice à court terme (évidence modérée) et contre l'acide hyaluronique dans la gonarthrose symptomatique (évidence modérée). La société médicale américaine pour la médecine du sport (American Medical Society for Sports Medicine) a également publié des recommandations en 2021 qui soutiennent l'utilisation du PRP en comparaison à la cortisone et à l'acide hyaluronique dans l'arthrose du genou, admettant que le niveau de preuve est plus limité pour les autres types d'arthrose [11]. En Europe, l'association orthopédique britannique (British Orthopaedic Association) n'a pas mené de travaux de recommandations directement, mais a rapporté le constat de l'institut national pour la santé et l'excellence clinique (National Institute for health and Care Excellence) basé sur l'analyse en 2018 de 3 revues et méta-analyses et 5 essais cliniques randomisés contrôlés, que le PRP est un traitement sans risque, mais qu'il n'existe pas assez de preuve de son efficacité [12]. Selon le rapport de la BOA, il n'existe aucune preuve que le PRP peut restaurer le cartilage ou ralentir la progression de l'arthrose ; en revanche, les auteurs considèrent que le PRP peut améliorer les symptômes de l'arthrose du genou à court terme (1 à 2 ans). Le groupe de travail allemand sur la régénération tissulaire de la société allemande d'orthopédie et de traumatologie, qui compte 95 membres a mené une enquête en 2018 qui a considéré le PRP comme utile, en particulier dans l'arthrose du genou de grade 2 sur l'échelle de Kellgren & Lawrence et dont la place dans les stratégies thérapeutiques augmentera de manière importante dans le futur [13]. Les recommandations du Groupe de Recherche International sur les Injections de PRP publiées en 2020 ont regroupé l'avis de 15 experts francophones sur 25 recommandations et ces derniers ont jugé que l'injection de PRP est un traitement symptomatique efficace de la gonarthrose précoce à modérée (niveau d'évidence 1A) et utile dans la gonarthrose sévère (niveau d'évidence 2B) [14]. Les recommandations les plus récentes proviennent du groupe européen sur la traumatologie du sport, la chirurgie du genou et l'arthroscopie (European Society of Sports Traumatology, Knee surgery and Arthroscopy).
Ces 28 recommandations, présentées au congrès de l'ESSKA à Paris en avril 2022, ont été le fruit d'un travail utilisant la méthodologie Delphi et aboutissant à la validation des recommandations au sein de plus de 30 sociétés savantes européennes parmi lesquels la Société Française d'Arthroscopie [15]. Parmi les recommandations de Grade A, le consensus conclut qu'il y a assez d'évidences cliniques et précliniques pour confirmer l'utilité du PRP dans l'arthrose du genou, en particulier dans les stades d'arthrose radiologique ≤ 3 sur l'échelle de Kellgren et Laurence ; que le PRP est plus sûr, non chondrotoxique et plus efficace au cours du temps que les corticostéroïdes. Une recommandation de grade B a également été attribuée sur la supériorité du PRP en comparaison à l'acide hyaluronique. Il est intéressant de constater la grande hétérogénéité dans les conclusions des différentes sociétés savantes (tableau 2) qui pourrait être expliquée par les différences dans les méthodologies utilisées ou le moment de la réalisation de la revue de la littérature. À ce sujet et concernant l'AAOS, une revue technologique dédiée à l'analyse de la littérature sur le PRP a été émise depuis les dernières recommandations et tient compte des articles et méta-analyses publiés en 2021 sur le sujet, correspondant ainsi à la revue de la littérature réalisée par l'ESSKA, avec une conclusion enthousiaste rapportant que le PRP offre des avantages significativement plus importants par rapport au placebo et aux alternatives telles que l'acide hyaluronique, les corticostéroïdes et les AINS, sur la douleur et les symptômes liés à l'arthrose du genou jusqu'à 12 mois après l'injection [16].
Recommandations - Utilisation clinique L'hétérogénéité des protocoles de préparation et de soins est soulignée quasi systématiquement par les sociétés savantes publiant des recommandations. Il s'agit parfois d'organismes de références tels que NICE, l'OARSI ou l'ACR qui citent des résultats contradictoires et une hétérogénéité des pratiques limitant la recommandation d'utilisation du PRP à ce jour, dans l'attente de nouvelles études de haute qualité. C'est dans ce contexte que les MIBO évoqués plus tôt sont apparus. Ces recommandations consistent à rapporter dans les études utilisant des produits orthobiologiques 23 paramètres dont 9 sont en lien avec la préparation et la caractérisation du PRP lorsque ce dernier est étudié. La nécessité d'une meilleure caractérisation et compréhension des mécanismes d'action associés au PRP a également été soulignée et diffusée par le comité scientifique et de normalisation sur la physiologie des plaquettes de la Société internationale de Thrombose et d'Hémostase (International Society on Thrombosis & Haemostasis) [17]. Les MIBO ont ensuite été reprises dans un document publié par l'AAOS suite à un think tank dédié, réalisé en 2018 dont le sujet était l'optimisation de l'utilisation clinique des produits orthobiologiques en chirurgie orthopédique [18].
La mise en place de registres « en vie réelle » est l'autre recommandation phare issue de ce think tank dont le but est de recueillir des données normalisées sur l'état et les résultats cliniques d'interventions différentes effectuées pour traiter la même pathologie. L'AMSSM a renforcé cela en conseillant un contrôle qualité au moins périodique lorsque le PRP est utilisé en routine et la collecte de données d'évidence en vie réelle (ou real world evidence) à l'aide de questionnaires validés par la littérature et directement rempli par le patient. De son côté, l'ESSKA reconnaît que la réalisation d'un contrôle des qualités biologiques du sang et du PRP pourrait améliorer la compréhension de l'efficacité du PRP et devrait être recommandée dans les protocoles de recherches cliniques et si possible en routine, mais n'évoque pas la mise en place de registres d'étude en vie réelle.
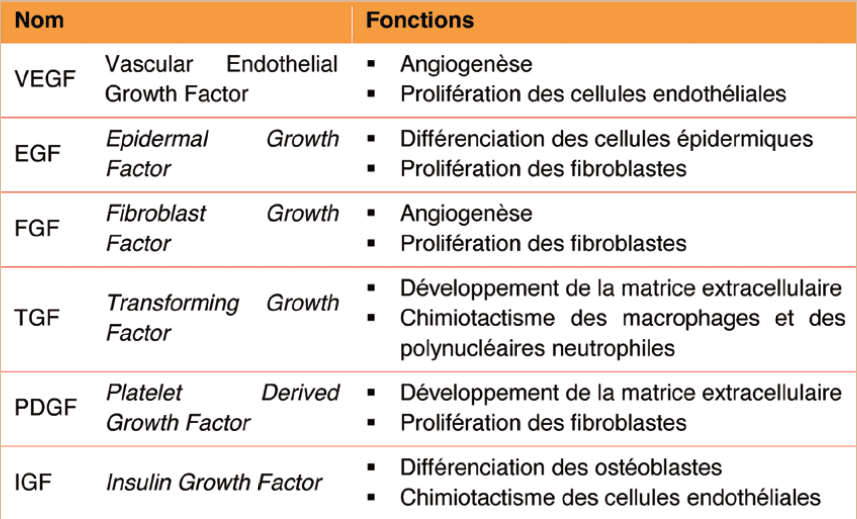
â² Tableau 1 Principales fonctions des facteurs de croissance plaquettaires
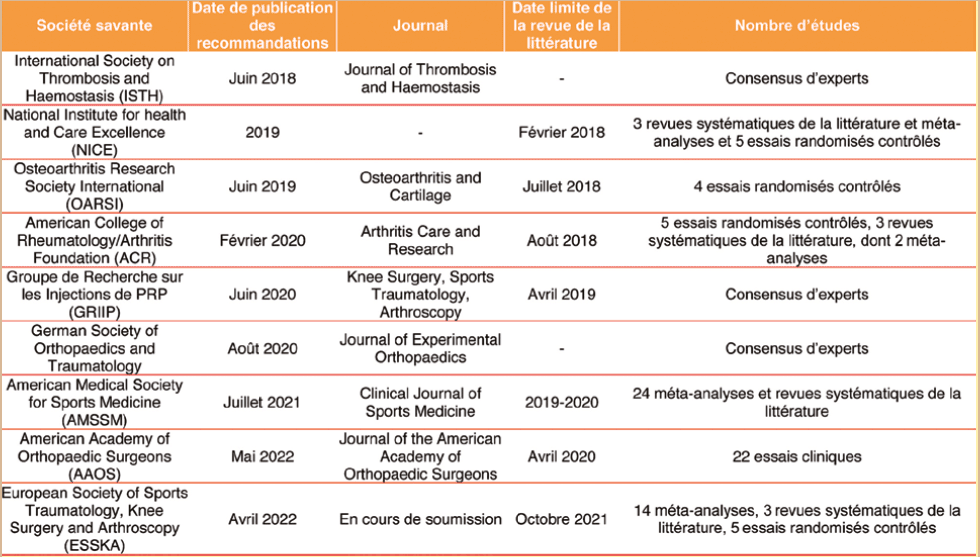
â² Tableau 2 Synthèse des recommandations d'efficacité clinique dans l'arthrose du genou