Prise en charge de la goutte en 2020
IntroductionLa goutte est le rhumatisme inflammatoire le plus fréquent de l'adulte. Elle est due aux dépôts de cristaux d'urate de sodium après une élévation chronique de l'uricémie définie par un taux plasmatique supérieur à360 µmol/L. Sa prévalence augmente dans le monde. En Europe, elle varie de 0.9 % en France à4.75 % en Grèce(1,2). Elle est de 3.9 % aux États-Unis et atteint plus de 10 % en Polynésie française, ou dans certaines populations aborigènes des îles pacifiques et de Taïwan(2). Bien que la maladie soit connue depuis l'antiquité et sa physiopathologie bien comprise, de nombreuses questions restent sans réponse. Par exemple, pourquoi seulement un tiers des patients hyperuricémiques forment des cristaux d'urate de sodium ou pourquoi et comment ces cristaux d'urate de sodium déclenchent des crises inflammatoires ou encore pourquoi ces inflammations sont autolimitées alors que les cristaux sont toujours présents. Malgré ces points non élucidés, la goutte est actuellement le seul rhumatisme inflammatoire chronique curable lorsque la prise en charge est bien effectuée, en impliquant de façon active le patient et en adoptant une stratégie de traitement àla cible comme le préconisent les dernières recommandations européennes(3).
Diagnostic positifLe diagnostic de certitude de la goutte repose sur la mise en évidence des cristaux d'urate de sodium lors de l'analyse soit du liquide articulaire soit d'une ponction d'un tophus. Typiquement, les cristaux d'urate de sodium apparaissent, en microscopie optique en lumière polarisée, fins àbout pointu en aiguille, avec une forte biréfringence négative (figure 1). En période intercritique, i.e. entre deux crises, la recherche des cristaux peut être effectuée en ponctionnant une articulation précédemment touchée par une crise inflammatoire, y compris la métatarso-phalangienne (MTP) du premier rayon(4).
Entre les mains expertes, cette procédure permet l'identification des cristaux dans 100 % des patients sans traitement hypouricémiant (THU). En l'absence de prélèvement, les dépôts de cristaux d'urate peuvent être recherchés par échographie ou par scanner àdouble énergie (DECT)(5). Les signes échographiques de dépôts de cristaux d'urate sont le double contour, le tophus et l'aspect en tempête de neige. La sensibilité et la spécificité du double contour, du tophus et de l'aspect en tempête de neige sont, respectivement, 65 % et 80 %, 83 % et 76 %, 30 % et 90 %(6). Le DECT permet de distinguer des dépôts de cristaux d'urate des cristaux calciques qui ont des propriétés d'atténuation des faisceaux d'électron différentes. La sensibilité et spécificité du DECT pour la détection des cristaux d'urate de sodium varient, respectivement, de 71 à97 % et de 84 à95 %(5). Le DECT est plus performant que l'échographie pour rechercher les dépôts au rachis.En l'absence de mise en évidence des cristaux d'urate de sodium, le diagnostic de goutte peut être retenu en présence des signes cliniques suivants : atteinte mono-articulaire du pied, en particulier de la MTP 1 (2.5 pts) ou de la cheville, crise antérieur identique (2 pts), installation maximale de la crise en moins de 24 heures (0.5 pts), rougeur (1 pt), homme (2 pts), antécédent de maladies cardiovasculaires ou HTA (1.5 pts), uricémie > 360 µmol/l au moment de la crise (3.5 pts). Un score ⥠8/13 permet de retenir le diagnostic de goutte avec une valeur prédictive positive de 87 %(7).L'hyperuricémie isolée ne permet pas le diagnostic de goutte.
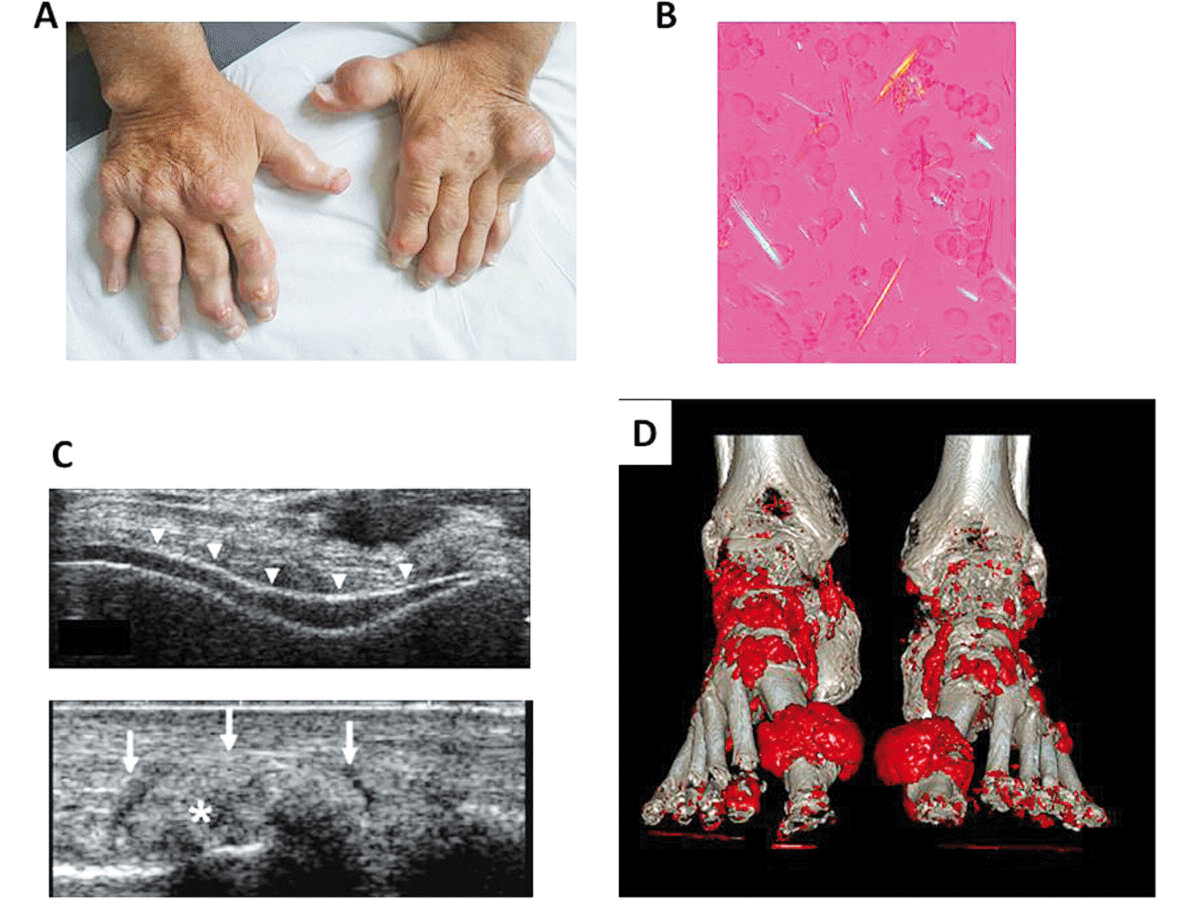
Figure 1. Goutte, maladie àdépôts de cristaux d'urate de sodium. (A) Tophus cliniques déformants. (B) Cristaux d'urate fins àbouts pointus en aiguille observés en lumière polarisée compensée. (C) Images échographique évocatrices de dépôts de cristaux d'urate : haut, image en double contour ; bas, image de tophus. (D) Tophus visibles au scanner double énergie.
Prise en charge de la goutteLes recommandations européennes et françaises (qui sont en préparation) insistent sur l'éducation des patients pour favoriser la compréhension de la maladie et augmenter l'observance qui constitue le réel problème thérapeutique(3). La goutte est une des maladies chroniques où l'observance thérapeutique est la plus basse, estimée entre 20 et 50 %. L'éducation du patient insistera sur la physiopathologie de la maladie en mettant en avant l'aspect génétique de la régulation de l'uricémie, la distinction entre le traitement symptomatique de la crise et le traitement hypouricémiant de la cause, et le caractère curable de la maladie.
La prise en charge de la goutte comprend la détection des comorbidités cardiovasculaires et leur traitement.
Le traitement de la criseL'efficacité du traitement de la crise de goutte est meilleure lorsqu'il est initié précocement. Les patients doivent être éduqués pour reconnaître les premiers signes des crises et être capables d'initier et de gérer leur traitement. Le choix du traitement de la crise dépend de la forme clinique de la crise (mono- vs oligo- ou poli-articulaire, atteinte grosse ou petite articulation), des comorbidités, en particulier de la présence d'une maladie rénale chronique (MRC), des co-prescriptions et des réponses antérieures. Les quatre traitements possibles sont la colchicine qui reste le traitement de première intention, les AINS, les corticoïdes en favorisant les injections intra-articulaires et les inhibiteurs de l'interleukine (IL)-1β. L'efficacité des 4 options thérapeutiques est équivalente(8–10). Les recommandations européennes préconisent de réserver l'inhibition de l'IL-1β aux crises résistantes àla colchicine et aux AINS ou aux patients où ces 2 traitements sont contre-indiqués et où l'emploi répété des corticoïdes risque de décompenser les comorbidités de la goutte. L'inhibition de l'IL-1β sera effectuée de préférence avec l'antagoniste recombinant du récepteur de l'IL-1 (anakinra) àraison de 100 mg/jour en injection sc. En effet, sa demi-vie courte, entre 4 et 6 heures, facilite la gestion des effets secondaires. À l'inverse, la demi-vie de l'anticorps monoclonal anti-IL-1β (canakinumab) est trop longue (28-30 jours) et ne convient pas au traitement de la crise de goutte dont l'évolution spontanée est une résolution en 7-10 jours.
L'efficacité des corticoïdes s'obtient àdes doses fortes équivalentes à30-35 mg/jour de prednisolone(8,9). Les injections intra-articulaires sont préférées lorsqu'elles sont réalisables. Elles sont aussi efficaces avec moins d'effets secondaires.
La colchicine est le traitement de première intention. Elle ne doit pas être associée aux macrolides et possède de nombreuses interactions médicamenteuses recensées sur le site internet https://www.drugbank.ca/drugs/DB01394. Elle est métabolisée par le cytochrome P450 3A4 qui a de nombreux inducteurs, inhibiteurs et substrats comme les anti-vitamines K, les statines, les imidazolés, anti-protéases ou encore la cyclosporine. En l'absence de MRC stades 4/5 (définie par une clairance inférieure à30 ml/min/1.73m2), la dose efficace est de 1 mg suivie une heure plus tard de 0.5 mg le premier jour. Aux jours suivants, la dose de 1.5 mg/jour est répartie en trois prises. Cette posologie est aussi efficace que les doses fortes avec 10 fois moins d'effets secondaires digestifs(11). La survenue d'une diarrhée doit être considérée comme un signe de surdosage et nécessite une diminution des doses ou un changement de traitement. Pour cette raison, ce signe digestif ne doit pas être masqué par l'utilisation du colchimax qui contient un ralentisseur du transit.
Le traitement hypouricémiantLe traitement qui permet de guérir de la goutte est le THU qui en diminuant l'uricémie en dessous de 300 µmol/L va permettre la dissolution des cristaux d'urate. Les nouvelles recommandations européennes préconisent de discuter et d'initier le traitement dès la première crise chez des patients jeunes moins de 40 ans, des patients avec une uricémie supérieure à480 µmol/l dosée àdistance de la crise et chez des patients avec comorbidités CV. Le THU est bien sûr indiqué en présence de crises inflammatoires répétées, d'arthropathie uratique, de tophus cliniquement palpable et de lithiase rénale d'acide urique. Il est initié àdistance d'une crise, en général 3-4 semaines après la résolution de la crise, àfaible dose et associé àun traitement prophylactique des crises par une faible dose de colchicine (0.5 mg/jour) pendant 6 mois ou jusqu'àla disparition des tophus cliniques(3). Les patients doivent être prévenus des risques de crise goutte lors de l'initiation du THU et être informés de l'objectif thérapeutique. Ces crises surviennent chez environ 30 % des patients et s'observent surtout dans les 6-9 premiers mois du THU chez des patients sans tophus clinique. Sa prévalence diminue lorsque le THU est initié àfaible dose(12).Les THU disponibles en France sont les 2 inhibiteurs de la xanthine oxydase (allopurinol et fébuxostat) et 2 uricosuriques (probénécide et benzbromarone après obtention de l'autorisation d'utilisation temporaire ou ATU). Le traitement de première intention est l'allopurinol en raison de sa bonne tolérance et plus faible coût par rapport au fébuxostat. En effet, des données récentes montrent que le traitement par fébuxostat est associé àun risque de mortalité CV et de mortalité globale augmenté par rapport àl'utilisation de l'allopurinol(13,14). L'agence américaine des médicaments (FDA) déconseille l'utilisation du fébuxostat chez des patients avec antécédents de maladies CV(14). Le fébuxostat est donc réservé aux patients intolérants àl'allopurinol (réaction allergique, en particulier) ou aux patients où l'allopurinol ne peut pas être utilisé àpleine dose (dose maximale limitée 100 mg/jour chez les patients avec MRC stades 4/5). Il est métabolisé par le foie, et peut être utilisé chez des patients avec MRC sévère sans adaptation des doses avec une bonne efficacité et une bonne tolérance(15). En présence de maladies CV et d'intolérance àl'allopurinol, l'utilisation des uricosuriques doit être favorisée.L'allopurinol lorsqu'il est utilisé avec une stratégie de traitement àla cible avec une adaptation mensuelle de sa posologie permet d'obtenir une uricémie inférieure à300 µmol/L chez plus de 88 % des patients après 2 ans de traitement(16). Dans cette étude, la dose moyenne de l'allopurinol pour obtenir une uricémie inférieure à300 µmol/L était de 460 mg/jour, obtenue en moyenne entre 4 et 5 mois après initiation du traitement(16).
Le risque de l'allopurinol est la réaction allergique cutanée grave qui survient dans les trois (àsix) premiers mois du traitement. Sa prévalence varie en fonction des ethnies, estimée à0.1-0.3 %, compliquée d'une mortalité de 15 à30 %. Les facteurs de risque d'allergie cutanée grave àl'allopurinol sont le portage de l'antigène HLA B5801, une dose initiale d'allopurinol trop élevée par rapport àla clairance de la créatinine, la MRC 4/5, le sexe féminin et l'utilisation des diurétiques(17–19). L'antigène HLA B5801 est associé àun risque relatif d'allergie cutanée grave de 70 àplus de 500. Sa prévalence varie en fonction des ethnies. Elle est importante pour la population Han de Chine et de Taïwan (jusqu'à20 %), les autres populations asiatiques (de 7 à10 %) et certaines populations africaines. Elle est faible chez les Caucasiens et les japonais (inférieure à1 %).
Les études médico-économiques conseillent le typage de cet antigène avant l'initiation de l'allopurinol dans les populations où sa prévalence est supérieure à4 %.
Cette précaution d'emploi est signalée dans le Vidal, adoptée aux États-Unis. À Taïwan, cette stratégie thérapeutique a permis d'éviter les réactions cutanées graves(20). L'initiation de l'allopurinol àfaible dose permet aussi de diminuer le risque d'allergie cutanée grave.
La dose initiale journalière d'allopurinol en mg doit être inférieure àla fonction rénale estimée par le débit de filtration glomérulaire (DFGe) exprimé en ml/min/1.73m2. Ainsi le ratio dose initiale d'allopurinol/DFGe doit être inférieur à1(19). Au-delàde 3 mois, le risque d'allergie cutanée grave est faible.
Le THU est maintenu àvie, en l'absence d'intolérance.
