Nouveautés concernant le Myélome Multiple
Liens d'intérêts : Subventions ou contrats : BMS, Janssen Honoraires : Janssen, BMS, Sanofi, GSK Financement déplacement : Janssen, BMS, Sanofi, Amgen Comités consultatifs : Janssen, BMS, Takeda, Amgen
Le myélome multiple : définition, critères de traitement et cytogénétique Le myélome multiple (MM) représente 1 % de tous les cancers, et la deuxième hémopathie maligne la plus fréquente après les lymphomes non hodgkiniens, avec en 2020, 176 000 nouveaux cas dans le monde et 117 000 décès (Siegel et al, Cancer Statistics, Cancer J Clin 2016). En France, pour l'année 2018, le nombre de nouveaux cas était de 5 442 dont 2 822 cas chez l'homme et 2 620 cas chez la femme (Santé Publique France). Le MM est toujours bien défini par une prolifération clonale de plasmocytes tumoraux dans la moelle osseuse. Ce qui a changé, c'est d'une part les critères de traitement du MM qui ne sont plus limités aux critères « CRAB » mais qui incluent les critères dit « SLiM » (> 60 % plasmocytes médullaire, ratio de chaines légères libres > 100 et plus d'une lésion focale à l'IRM du rachis)[1]. Sur le plan biologique, on retrouve toujours des anomalies initiales de type translocations impliquant le locus des chaines lourdes des immunoglobulines (# 50 %) et des hyperdiploïdies (# 50 %) mais les facteurs de haut risque cytogénétiques sont constamment révisés compte tenu des immenses progrès thérapeutiques. En effet, les critères consensus les plus récents comprennent : la présence d'une del(17p) (avec un seuil de 20 %) et/ou la présence de mutation de P53, la présence d'une translocation t(4 ;14) ou t(14 ;16) ou t(14 ;20) associée à un gain de 1q et/ou une del(1p), la présence d'une del(1p32) plus gain 1q ou une délétion bi-allélique de 1p32. (N. Munshi, IMS 2023). Pas encore d'essai dédié spécifiquement à cette catégorie de malades récemment identifiée représentant 15-20 % des MM. En revanche, au-delà des anomalies cytogénétiques, de plus en plus d'études cliniques sont basées sur la détection d'une maladie résiduelle (MRD) à 10-5 (PCR ou cytométrie de flux) ou 10-6 (PCR), étant données les progrès thérapeutiques considérables.
Des progrès thérapeutiques ? Traitement de première ligne des patients éligibles et non éligibles au traitement intensif Pour la première ligne, les sujets éligibles au traitement intensif (âge allant potentiellement jusqu'à 70 ans), l'objectif est d'obtenir une réponse profonde, avec une maladie résiduelle négative. La profondeur de la réponse en induction est, encore aujourd'hui, corrélée à la durée de la PFS après l'autogreffe (Moreau et al, Blood 2011). De même, la profondeur de la maladie résiduelle est corrélée avec la survie globale et la survie sans progression, indépendamment de la cytogénétique et des classes thérapeutiques utilisées[3,4]. Le traitement standard consiste maintenant en une induction avec 4-6 cycles de « quadriplets » incluant un anticorps monoclonal anti-CD38, un Immunomodulateur (Imids), un inhibiteur du protéasome (IP) et la dexamethasone, le traitement intensif par alkeran (Melphalan) à forte dose suivi de la réinjection de cellules souches hématopoïétiques périphériques (autogreffe), une consolidation utilisant les mêmes drogues qu'à l'induction, suivi d'un traitement d'entretien d'au moins 3 ans (lenalidomide)[5,6]. Avec ce schéma, et même avec une induction par « triplets » avant l'ère des anti-CD38, la médiane de survie atteint environ les 10 ans, mais sans véritable guérison, faisant du MM une vraie maladie chronique. Près de la moitié des malades sont en rémission complète après le traitement d'induction et après la consolidation, 90 % des malades sont répondeurs dont ¾ en très bonne réponse. Aujourd'hui, l'efficacité des quadriplets est telle qu'on espère obtenir au moins 50 % de malades avec MRD indétectable à 10-5 après le traitement d'induction, faisant à nouveau questionner la nécessité de l'autogreffe. Chez les malades de « haut risque » cytogénétique, définis anciennement par la présence d'une translocation t(4 ;14) et/ou del(17p), il a été fortement suggéré que deux autogreffes permettent un meilleur du taux de réponse[7]. C'est donc logiquement que l'IFM (Intergroupe Francophone du Myélome) a réalisé un essai thérapeutique basé sur la MRD, avec un bras « favorable » permettant de remettre en cause le traitement intensif et un bras « haut risque » posant la question cette fois randomisée de la nécessité d'une double autogreffe (protocole MIDAS, Figure 1). Les inclusions sont terminées et les résultats de cette étude sont en attente. Ces progrès sont aussi visibles chez les malades non éligibles à l'autogreffe. En effet, la simple combinaison entre un anticorps monoclonal anti-CD38 et un Imid comme le lenalidomide, associé à la dexamethasone conduit en première ligne à une médiane de survie sans progression à 62 mois[8]. Ce régime de traitement est globalement bien toléré et s'est installé comme nouveau standard de traitement chez les sujets âgés. Ces résultats signifient que la progression du myélome n'est plus la cause majeure de mortalité dans les 5 ans qui suivent le diagnostic. Bien entendu, dans cette population, il faut distinguer sur la plan pratique les patients dits « fit » des patients fragiles « unfit ». Idéalement, l'évaluation gériatrique à l'aide des scores de Charlson, ADL et IADL sont nécessaires (REF). En pratique, et pour éliminer une population « intermediaire », on considère des scores simplifiés prenant en compte l'état général (OMS, PS) et le test de Charlson ou le test de marche[9]. Chez les sujets dits « fragiles », des études visant à épargner la dexamethasone en ne gardant que l'association Imid plus anti- CD38 semblent prometteuses. Dans tous les cas le traitement doit alors être poursuivi, au besoin sous forme d'entretien pendant plus de 18 mois.
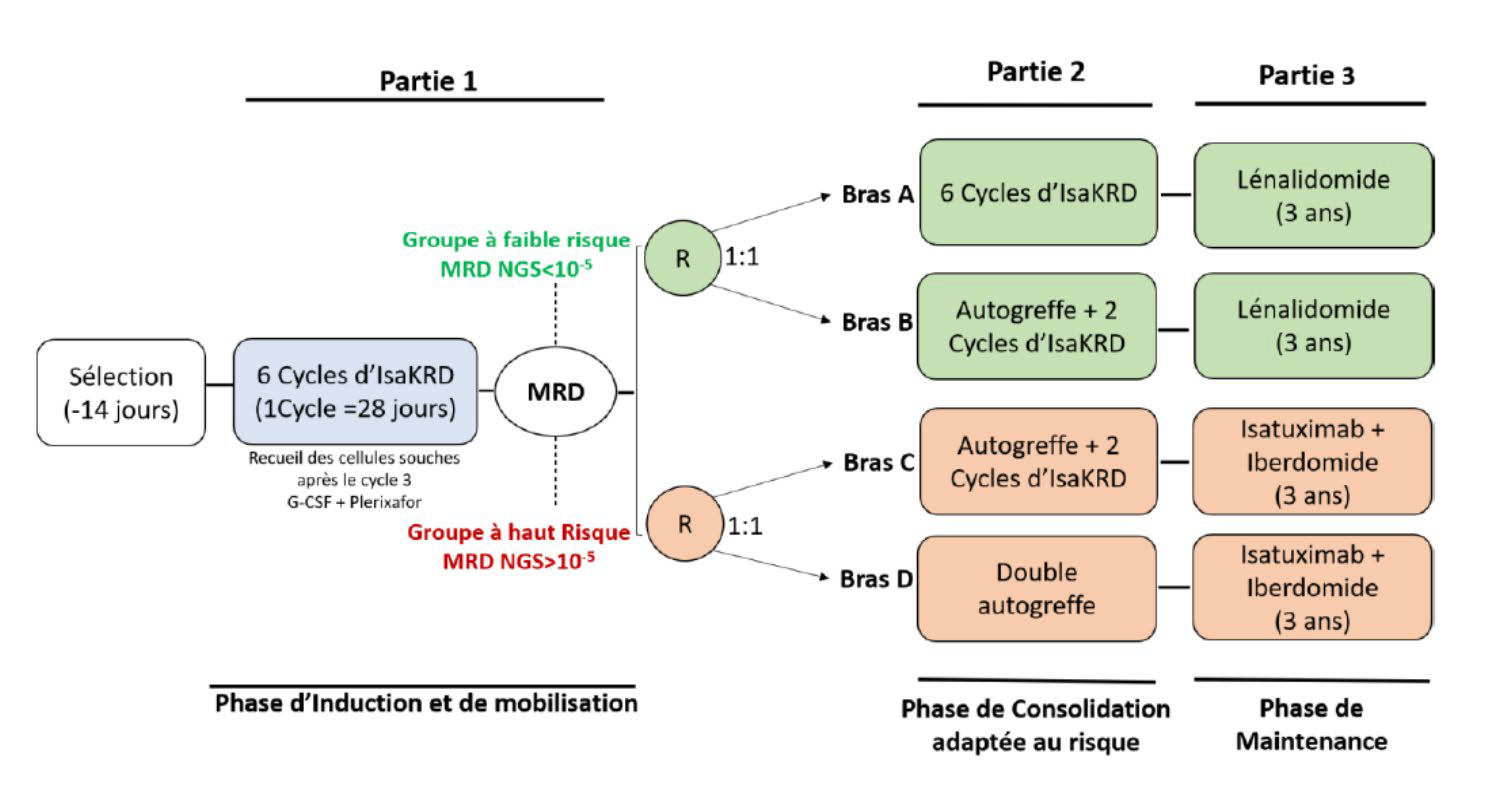
Figure 1 : Schéma de l'étude « MIDAS » (IFM)
Traitements de première et deuxième rechute Ces traitements reposent sur des triplets de combinaison utilisant les médicaments des trois principales classes thérapeutiques (Imids, IP et anticorps monoclonal anti-CD38) avec des générations successives (lenalidomide, pomalidomide pour les Imids, bortezomib, carfilzomib pour les IP). La stratégie dépend surtout du caractère réfractaire au lenalidomide (si la rechute survient sous ou dans les deux mois qui suivent l'arrêt). Chez ces malades, les associations Carfizomib et anti-CD38 (Isatuximab, daratumumab), Carfilzomib/bortezomib et pomalidomide ou anti-CD38 et pomalidomide entrainent des réponses profondes avec une médiane de survie sans progression intéressante[7]. Pour les malades réfractaires au lenalidomide plus anti-CD38, on privilégiera les associations pomalidomide et IP.
Traitements des rechutes ultérieures : Immunothérapies anti-BCMA Les nouvelles stratégies d'immunothérapies sont venues une nouvelle fois bouleverser le pronostic des patients avec MM, en apportant une efficacité remarquable dans des situations considérées il y a peu de temps comme des impasses thérapeutiques. Même si ces stratégies ne permettent pas encore d'envisager une guérison lorsqu'elles sont utilisées en rechute, leur utilisation précoce et/ou en combinaison paraissent encore plus prometteuses. Ces nouvelles immunothérapies consistent en l'utilisation d'anticorps monoclonaux bispécifiques et des CAR T.
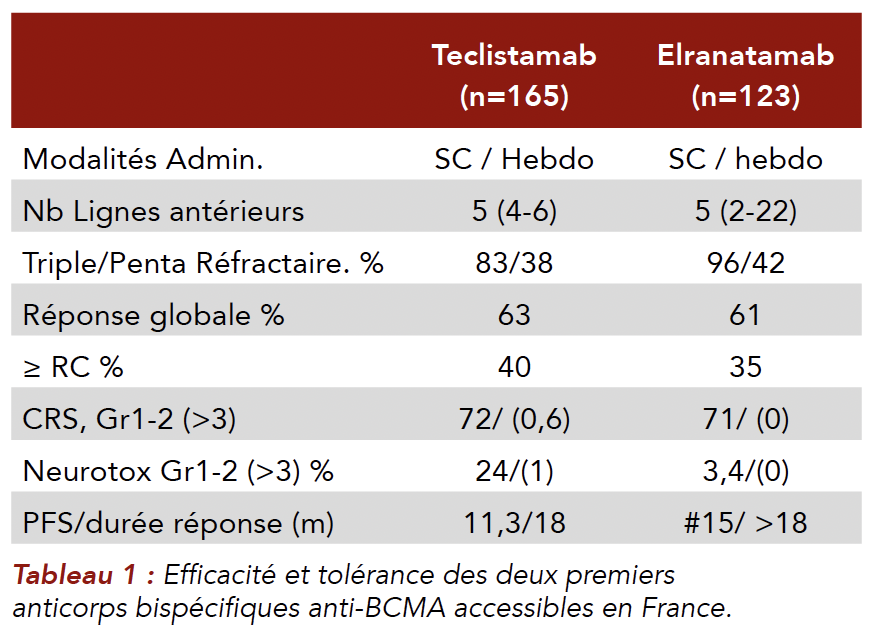
Les anticorps bispécifiques anti-BCMA/antiCD3 Parmi les nouvelles stratégies d'immunothérapie, les anticorps bispécifiques (BsAb) dirigés par BCMA ont démontré un taux de réponse global impressionnant (ORR) compris entre 63 % et 70 % en fonction du BsAb utilisé[6-8] souvent avec négativité de la maladie résiduelle (MRD), et une survie de progression et une survie globale fortement améliorées chez les patients atteints d'une maladie avancée. Ces résultats ont conduit à l'approbation récente par la FDA du Teclistamab et de l'Elranatamab, deux BsAb dirigés contre le BCMA, chez les patients progressant après 4 lignes de traitement ou plus, y compris les Imids, l'inhibiteur du protéasome (IP) et l'anticorps monoclonal anti-CD38 (Tableau 1)[10,11]. De nombreux autres anticorps bispécifiques anti-BCMA sont aussi en développement[12]. Plusieurs essais ont mis en évidence des événements indésirables (EI) associés aux BsAb, tels que le syndrome de libération des cytokines (SRC), la cytopénie, l'hypogammaglobulinémie et les infections[13-15]. Un risque plus élevé d'infections graves et de décès liés à une infection a également été signalé dans les essais cliniques[13-19]. Les incidences signalées d'infections de tous grades sont de 46 à 76 %, dont 7 à 45 % sont des événements de grade 3 ou 4. Il est intéressant de noter que les infections sont en partie bactériennes en raison d'une immunosuppression humorale profonde, mais des infections opportunistes se sont également produites, reflétant une grave anomalie des lymphocytes T,13,14. Ce taux élevé d'infection peut nuire au pronostic du patient. De plus, l'épuisement des lymphocytes T pourrait également entraîner une rechute et représenter une limite à l'utilisation des BsAb. La substitution par immunoglobulines polyvalentes (IG) intra-veineuse ou sous cutanée, en plus des prophylaxies parasitaires et virales, est requise dès le début du traitement. L'espacement des injections voire l'utilisation du produit à durant une période limitée sont encore à l'étude pour en limiter les complications.
Les CAR T cells anti-BCMA Deux CAR T anti-BCMA, de deuxième génération avec domaine de costimulation 4-1BB sont maintenant approuvés par la FDA, l'Ide-cel et le Cilta-cel chez les malades ayant reçu plus de 3 lignes de traitement et exposés aux trois classes (Imids, Inhibiteurs du protéasome et anticorps monoclonaux anti-CD38)[20,21]. Les résultats des deux CAR T sont rappelés dans le Tableau 2. De façon très importante, les résultats des études princeps (KarMMa pour l'Ide-cel et CARTITUDE pour le Cilta-cel ont été confirmés dans mes études de « vraie vie » US et Française (étude FENIX, ASH 2023 poster 2035, à partir du registre DESCAR T rassemblant tous les patients traités par CAR T en France hors essai clinique)[22]. Citons en particulier l'actualisation de l'étude CARTITUDE-I (N = 97 patients), évaluant l'efficacité et la tolérance du Cilta-cel montrant, avec un suivi médian de 33,4 mois, un taux de réponse globale de 98 % dont 82 % de RC et la médiane de survie sans progression (SSP) est de 34,9 mois, ce qui est tout à fait impressionnant pour ce type de population ayant déjà reçu une médiane de 6 lignes de traitement (Figure 2). Même si les études ne sont pas comparables entre elles ces résultats semblent supérieurs à ceux de l'Ide-cel, déjà très efficace chez des malades multi-traités. Chez les malades en maladie résiduelle (10-5) négative et chez les malades en RC avec respectivement 74 % et 66 % de patients sans progression à 30 mois. Pour l'ensemble des malades, la médiane de survie globale n'est pas atteinte mais 62,9 % sont en vie à environ 3 ans. Les principaux facteurs pronostiques mis en évidence sont la forte masse tumorale, les haut risque cytogénétiques et les malades avec lésions extra médullaires (EMD). La tolérance du traitement est globalement correcte avec un taux de CRS de % (% grade > 3) et un taux d'ICAN de % (% grade > 3) avec une toxicité non ICAN sous forme de paralysie faciale ou neuropathie périphérique d'environ 10 % Une des grandes orientations du traitement par CAR T anti BCMA est leur utilisation plus précoce dans l'histoire naturelle de la maladie. L'étude KarMMa-3 a montré la supériorité de l'Ide-cel (N=256) par rapport aux triplets « standard » chez les patients ayant reçu 2 à 4 lignes thérapeutiques préalables (survie sans progression 13,3 versus 4,4 mois)[23]. L'étude de phase III CARTITUDE-4, a comparé le Cilta-cel au triplet de traitement standard (DPD ou DVD) chez les malades ayant reçu 1 à 3 lignes de traitement antérieurs et réfractaires au lenalidomide[24]. Dans chaque bras, 208 patients ont été inclus. Dans le bras Cilta-cel, 176 patients ont été réinjectés. Le taux de réponse globale est de 85 % dont 73 % de RC dans le bras Cilta-cel contre 67 % dans le bras standard. À 12 mois, la SSP est de 76 % dans le bras Cilta-cel versus 49 % dans le bras standard (médiane de SSP du bras standard : 11,8 mois). Si on considère uniquement les 176 malades ayant reçu le Cilta-cel, le taux de réponse globale était de 99 % dont 86 % de > RC et la SSP est de 90 % à 12 mois. Le taux de MRD négativité à 10-5 est 3 à 4 fois supérieur dans le bras Cilta-cel. Ces résultats impressionnants, vont certainement mener à l'approbation du Cilta-cel dès la première rechute chez les patients réfractaires au lenalidomide. Dans cette étude, le délai médian entre l'aphérèse et la réinjection des CAR T était de 79 jours, délai difficile à gérer en pratique. Actuellement en France seul l'Ide-cel est disponible dans le cadre d'un accès précoce et le délai entre l'aphérèse et la réinjection des CAR T est entre 4 et 6 semaines. Concernant l'utilisation plus précoce des CAR T et la recherche de facteurs pronostiques, a été présentée à l'EHA 2023 une analyse en sous-groupes de l'étude de phase III KarMMa-3, testant l'efficacité de l'Ide-cel versus traitement standard, chez les malades ayant reçu préalablement 2 à 4 lignes de traitement et réfractaires à leur dernier traitement. En dehors de la présence d'anomalies de haut risque cytogénétiques, les facteurs influant négativement la réponse et la SSP sont principalement l'ISS3 et la présence d'une maladie extra-médullaire, ce qui avait été aussi noté dans l'étude de vraie vie Française sur les 50 premiers patients traités par Ide-cel dans le cadre de l'accès précoce (FENIX). On retrouve également le mauvais pronostic du syndrome inflammatoire au moment de l'aphérèse avec ferritinémie élevée et aussi la persistance d'un syndrome tumoral à 2 et 6 mois post CAR T, mesurée par le taux de BCMA soluble. En conclusion, les données présentées confirment l'efficacité remarquable du CAR T anti BCMA Cilta-cel non seulement chez les malades lourdement traités mais aussi en première rechute chez les patients réfractaires au lenalidomide. Pour les malades traités par Ide-cel, les facteurs pronostiques majeurs sont une forte masse tumorale et la présence de lésions extramédullaires, ainsi qu'un syndrome inflammatoire au moment de l'aphérèse. Il semble que l'utilisation plus précoce des CAR T soit associée à une meilleure efficacité et probablement une moindre toxicité. Reste à savoir les résultats des études en cours utilisant les CAR en première ligne pour les malades éligibles et non éligibles au traitement intensif (études CARTITUDE 5, CARTITUDE 6, KarMMa 9). En attendant l'utilisation de plateformes permettant de réduire la durée de manufacture permet d'entrevoir une amélioration de l'efficacité et de la persistance des CAR T.
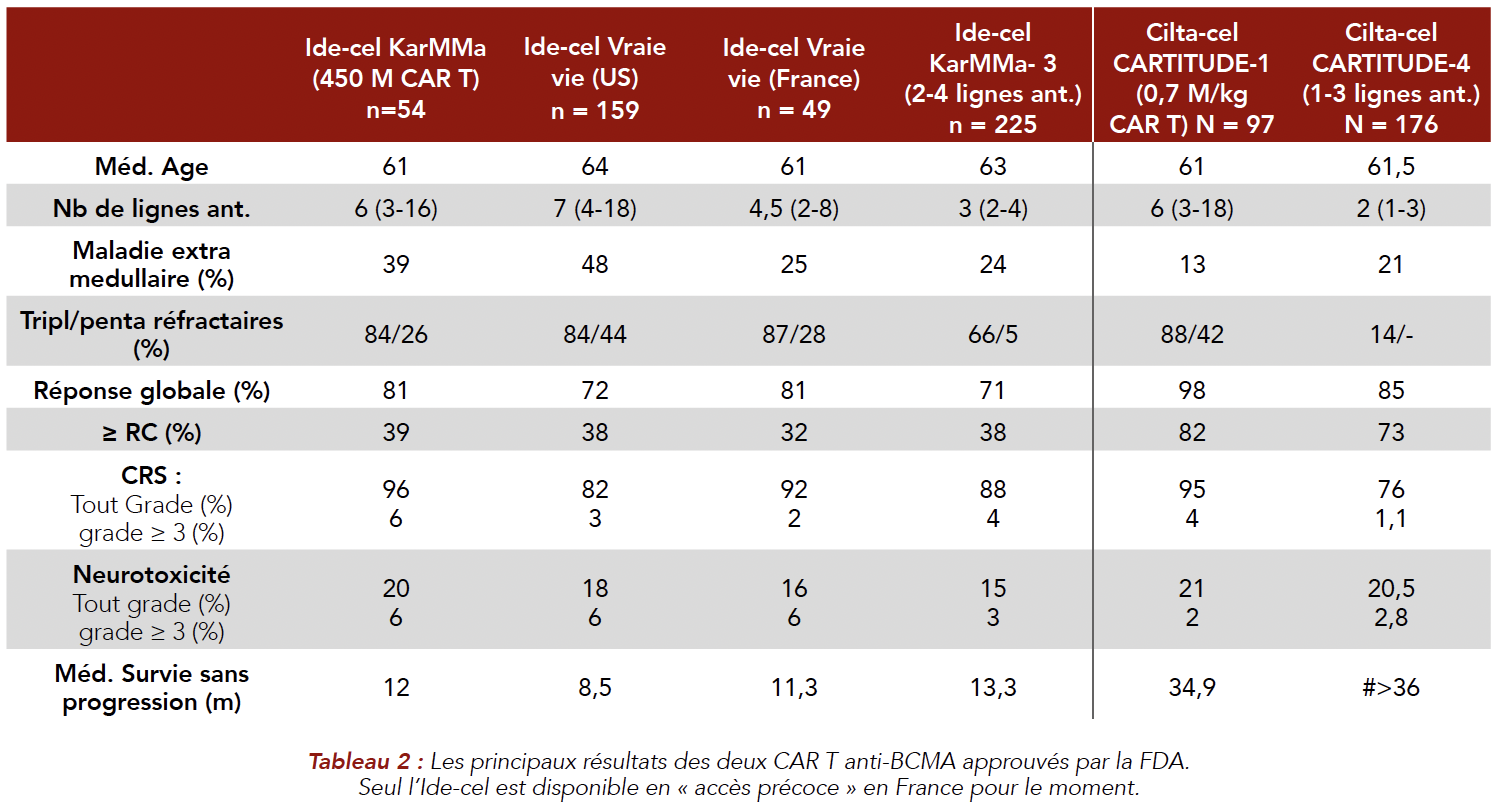
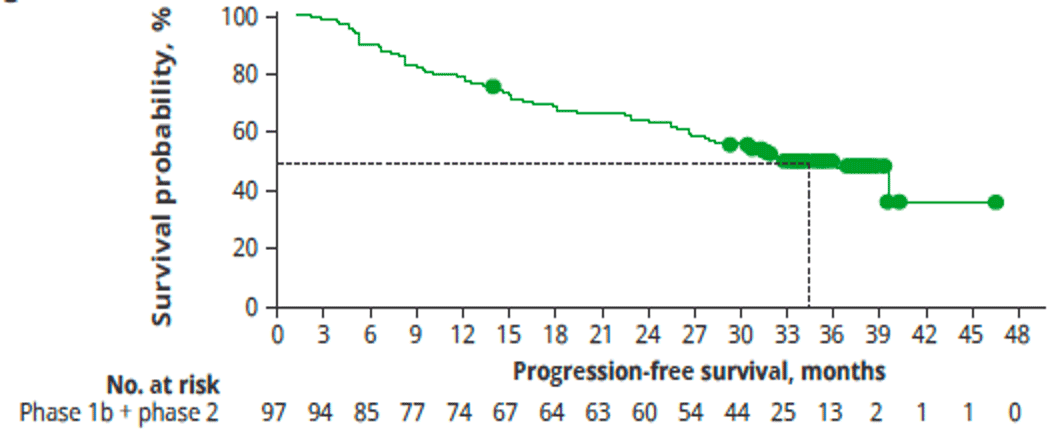
Figure 2 : Étude CARTITUDE-1 SSP avec 33.4 mois de suivi montrant l'efficacité jamais encore rapportée chez les malades ayant reçu une médiane de 6 lignes de traitement antérieurs (médiane SSP : 34,9 mois)
Après le BCMA, de nouvelles cibles pour l'immunothérapie Enfin le développement de CAR T et d'anticorps bispécifiques dirigés contre d'autres cibles va permettre d'améliorer le panel des immunothérapies dans l'ère « post-BCMA ». Pour les CAR T, même si la perte d'expression du BCMA (délétion biallelique) n'est retrouvée que dans environ 4 % des cas après échappement, un moyen de contourner la résistance aux CAR T anti BCMA est d'utiliser de nouvelles cibles exprimées à la surface des plasmocytes. Dans cette démarche, plusieurs CAR anti GPRC5D sont en cours de développement25. À l'EHA a été rapportée une étude préliminaire concernant le CC96266, CAR de deuxième génération anti GPRC5D avec escalade de dose chez 67 malades. La médiane du nombre de lignes antérieures de traitement était de 4 et 35 % des malades étaient penta-réfractaires. De façon intéressante 44 % des malades avaient reçu un traitement anti-BCMA préalable dont 30 % des CAR T anti BCMA. Le taux de réponse globale était de 86 % dont 20 % de RC pour l'ensemble des malades. En cas de traitement par anti BCMA préalable le taux de réponse globale était de 76 % dont 40 de RC contre 96 % dont 36 % de RC chez les malades sans traitement anti-BCMA antérieur. La toxicité semble identique aux autres CAR T anti-GPRC5D. Le taux de CRS était de 86 % dont 2 % de grade > 2. Le recul était encore trop court pour mesurer la durée de SSP. Pour les anticorps bispécifiques, les anti-GPRC5D/anti CD3 comme le talquetamab, ont déjà été testés avec un taux de réponse comparable aux anti-BCMA et même avec efficacité en cas de traitement préalable par immunothérapie anti-BCMA26. La toxicité au niveau des phanères, de la peau et du tube digestif peut représenter une limite à l'utilisation de ces anticorps puisque le GPRC5D n'est pas complètement spécifiquement exprimé sur les plasmocytes. Enfin, les mécanismes de résistance aux anti-GPRC5D pourrait impliquer plus souvent une perte/mutation de l'antigène. Des anticorps bispécifiques dirigés contre d'autre cibles comme le FCRH5 sont aussi en développement avec des premiers résultats encourageant, y compris pour les patients ayant reçu un traitement anti-BCMA préalable26. Reste à savoir comment sélectionner les malades et comment mener la stratégie de séquence de ces différents outils thérapeutiques. Des données sur un faible nombre de malade laissent supposer qu'il est préférable d'utiliser un CAR T anti-BCMA avant un bispécifique anti-BCMA. Des études testant l'efficacité et les effets indésirables des association bispécifiques anti-CD38 et/ou Imids, voire de plusieurs bispécifiques (anti-GPRC5D/anti-BCMA) sont en cours actuellement. En parallèle les anticorps bispécifiques vont très prochainement être évalués en première ligne.
Conclusion Du fait de ces avancées thérapeutiques le pronostic du MM a réellement changé pour une maladie plutôt chronique, encore hétérogène, avec de belles perspectives dans cette dynamique d'amélioration vers la guérison, notamment avec les progrès attendus des nouvelles immunothérapies dont nous sommes qu'à la première étape.
