Les HIFU (Ultrasons Focalisés de Haute Intensité) comme alternative mini-invasive à la chirurgie dans la prise en charge de l'endométriose profonde et de l'adénomyose
Introduction La prise en charge des patientes souffrant d'endométriose est complexe car elle doit s'adapter aux symptômes des patientes et à leurs retentissements sur la qualité de vie de celles-ci. L'existence d'un désir de grossesse est également un élément central pour guider les choix thérapeutiques. Les recommandations HAS/CNGOF de 2018 proposent en première intention l'utilisation d'un traitement hormonal visant l'aménorrhée, en l'absence de projet obstétrical [1]. Le traitement chirurgical n'est généralement proposé qu'en cas d'échec du traitement médical ou de contre-indications à ces traitements. Si une grossesse est envisagée, en particulier en cas d'infertilité associée, il faudra peser les bénéfices et les risques d'une intervention chirurgicale avec la possibilité d'un recours immédiat à l'aide médicale à la procréation. Selon la localisation des lésions et leur nombre, le traitement chirurgical peut correspondre à des interventions très différentes dont les risques per- et post-opératoire peuvent également varier de façon importante. À l'inverse de la chirurgie oncologique, qui privilégie généralement la survie à la qualité de vie, la chirurgie de l'endométriose est une chirurgie dite « fonctionnelle ». En effet, cette pathologie ne menaçant habituellement pas la survie de la patiente, les gestes chirurgicaux doivent viser à améliorer la douleur de la patiente en préservant au maximum la fonction des organes concernés et en limitant les gestes radicaux. Cependant, les lésions d'endométriose sont classiquement multifocales et infiltrent les tissus des organes pelviens comme des lésions cancéreuses, ce qui rend les chirurgies de résection de l'endométriose assez « délabrante » malgré tout, avec des risques de séquelles parfois invalidantes notamment sur les fonctions urinaires ou digestives. Depuis plusieurs années, la tendance est plutôt en faveur d'une limitation des indications opératoires dans l'endométriose et à des gestes les plus conservateurs possibles sur les organes pelviens, pour s'éloigner petit à petit des interventions de résection basées sur la chirurgie oncologique. Ainsi, on privilégiera autant que possible la voie cœlioscopique classique ou robot assisté et on tentera de limiter par exemple les résections digestives segmentaires multiples ou étendues, les annexectomies ou les hystérectomies. En complément de cette « désescalade chirurgicale », plusieurs équipes proposent aujourd'hui des techniques de résection ou de destruction des lésions d'endométriose moins invasives que celles proposées en chirurgie conventionnelle basées sur l'endoscopie, les techniques percutanées et la diminution des sutures. Dans ce chapitre nous décrirons les principes des Ultrasons Focalisés de Haute intensité (HIFU) et leurs principales indications potentielles dans l'endométriose comme alternative à la chirurgie conventionnelle.
Principe des HIFU Les HIFU pour High Intensity Focused Ultrasound, ou « ultrason focalisé de haute intensité » en français, font partie des ultrasons thérapeutiques. Ce sont des ondes ultrasonores de fréquence relativement proche de celles des ultrasons diagnostiques (0,8 – 5 MHz en général) mais dont la puissance est bien supérieure, d'une part au niveau de la source de l'onde sonore (le transducteur) et plus encore au niveau de la cible thérapeutique en utilisant le principe de focalisation acoustique. Pour augmenter l'énergie appliquée à la cible, il est possible de faire varier la durée du tir et la répétition des tirs dans le temps. L'objectif est généralement d'obtenir un effet thermique et physique au niveau d'un volume cible situé en profondeur, sans qu'il y ait d'effet notable dans les tissus traversés en aval de la zone cible. C'est cette propriété qui est à la base de leur intérêt thérapeutique.[2] Les effets biologiques des ultrasons sont généralement séparés en 2 catégories : les effets thermiques et les effets mécaniques (cavitation), dont la combinaison conduira à des lésions tissulaires par nécrose classiquement appelée « ischémique » ou « coagulation » [3, 4]. Une fois traité le tissu est habituellement remplacé par une zone fibreuse cicatricielle. En focalisant plusieurs faisceaux ultrasonores de haute énergie en un point donné du tissu, l'augmentation de température sera maximale au niveau de ce point et pourra entrainer une lésion thermique si la température atteinte et le temps d'application sont suffisants pour entrainer une nécrose tissulaire (Figure 1). Ainsi, l'un des principaux avantages des HIFU est qu'ils permettent la destruction focale d'une zone de tissu au niveau du point de focalisation (entre 1 et 15 mL selon les sondes utilisées) sans nécessité d'utiliser un applicateur transcutané et donc sans aucune cicatrice ni saignement.
Figure 1 : Évolution de la pression acoustique dans l'espace entre un transducteur HIFU et le point focal sur la lésion cible.
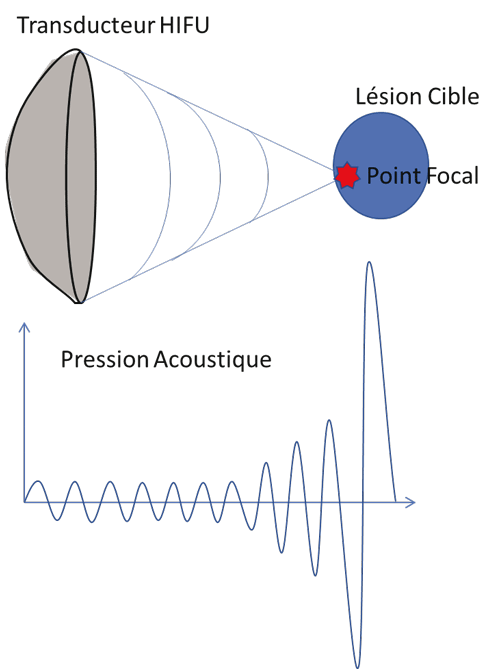
Légende : Grâce au phénomène de focalisation, le transducteur HIFU va permettre la concentration d'énergie au niveau du point focal sur la lésion cible sans endommager les tissus situés entre la sonde et la lésion cible. Endométriose pariétale et HIFU L'endométriose de la paroi abdominale correspond à l'existence de glande et/ou de stroma endométrial dans la paroi abdominale. Toutes les couches de la paroi abdominale peuvent être concernées de la peau aux muscles abdominaux et ce jusqu'au péritoine pariétal. Il s'agit d'une forme rare qui concernerait 0,03 à 3,5 % des patientes porteuses d'endométriose [5]. Il s'agit d'une forme assez spécifique d'endométriose profonde puisqu'elle est associée à un antécédent de césarienne dans 75 % des cas [6], alors qu'elle n'est associée à des lésions d'endométriose pelvienne que dans 0 à 34 % des cas selon les séries.[7, 8] Beaucoup de publications rapporte l'utilisation des HIFU pour le traitement de lésion d'endométriose pariétale. La plupart de ces publications proviennent de l'expérience chinoise sur le dispositif médical JC développé par la société HAIFU® (Chongqing, China) et très largement répandue dans ce pays. Dans ces séries, la patiente est habituellement placée sur le ventre avec son abdomen immergé dans une cuve d'eau contenant un transducteur HIFU et un transducteur d'imagerie. L'intervention est réalisée le plus souvent sous sédation consciente et parfois sous anesthésie générale. L'opérateur réalise le traitement sous contrôle échographique. Wang et al. en 2009 ont rapporté un première série de 21 patientes traitées sous sédation consciente pour des nodules uniques d'endométriose pariétale sur cicatrices de césarienne, dont 18 infiltraient le muscle grand droit avec une taille moyenne de 2, 3 cm3 [9] Il rapportait un taux de succès de 100 % sur les douleurs, tandis que 16 nodules (76 %) étaient devenus indétectables en échographie à 6 mois. Aucune complication n'était rapportée. Luo et al. ont ensuite publié une série sur 32 patientes avec 39 nodules traités sous sédation avec le modèle JC-200 de la marque HAIFU® (Chongqing, Chine). [10] La taille moyenne était de 2,4 cm3, la durée moyenne de la procédure de 40 min. À 6 mois post traitement, l'EVA était passée de 6,8 à 1,8 en moyenne et le volume en échographie avait diminué de 53 %. En termes de volume de déperfusion, la diminution de la vascularisation était de 94 %. Aucune complication n'avait été rapportée, seul un inconfort et un œdème dans les suites immédiates disparaissant spontanément. En 2018, Zhao et al. ont publié une étude rétrospective comparant le traitement par HIFU au traitement chirurgical [11]. Le groupe HIFU comprenait 25 patientes traitées sous sédation. La durée moyenne de la procédure était de 60 min. L'EVA à 6 mois était passée de 6,9 à 0,3 en moyenne. Une patiente (4 %) avait présenté une complication majeure (brûlure cutanée), 7 (28 %) des complications mineures (hématurie liée à un traumatisme lors de la mise en place de la sonde à demeure et aspect en peau d'orange) et 2 patientes (8 %) avaient présenté des symptômes de récidive à 5 et 6 mois. Le groupe chirurgical comprenait 29 patientes. L'intervention se déroulait sous anesthésie générale ou rachianesthésie. Comparativement au groupe HIFU la durée d'hospitalisation était plus longue (6,7 jours vs 4,4 jours), les pertes sanguines plus importantes (46 millilitres vs zéro). Dans le groupe chirurgie, 4 patientes (13,8 %) avaient présenté des complications majeures (infection pulmonaire ou retard important de cicatrisation) et 3 (10 %) des symptômes de récidive à 3, 12 et 20 mois post-opératoires. De même, Zhu et al. montrent dans un essai comparatif rétrospectif non randomisé sur 51 patientes une absence de différence significative sur les symptômes douloureux à 1, 3, 6 et 12 mois post-traitement entre les HIFU échoguidés et le traitement chirurgical, avec l'avantage pour la chirurgie d'une absence de lésion palpable résiduelle, mais l'avantage pour les HIFU d'une absence de cicatrice, de saignements nuls et d'une durée d'hospitalisation plus courte.[12] Une autre étude rétrospective publiée par Shi et al. en 2019 retrouvait les mêmes données avec 13 patientes dans le groupe HIFU et 17 dans le groupe chirurgie.[13] L'intervention se déroulait sous anesthésie générale dans le groupe chirurgie versus sédation dans le groupe HIFU. La durée d'hospitalisation était plus longue (5,2 vs 1 jours). Il y avait plus de complications dans le groupe chirurgie comparativement au groupe HIFU : 2 patientes (11,8 %) avaient présenté de la fièvre versus 0 (p=0,049) et 3 patientes (17,6 %) avaient présenté des complications urinaires (rétention d'urine, irritation vésicale) versus 1 patiente (7,7%) (hématurie) (p=0,043). L'efficacité était comparable en termes de diminution d'EVA (de 6 à 0,7 à 12 mois dans le groupe chirurgie vs de 5,8 à 0,6 dans le groupe HIFU). Il y avait eu une récidive à 12 mois dans le groupe chirurgie, aucune à 18 mois de suivi dans le groupe HIFU. Le traitement par HIFU apparaîtrait donc aussi efficace que le traitement de référence pour une durée d'hospitalisation moins longue et moins de complications avec les réserves que comportent les études rétrospectives non randomisées. En 2019, Xiao-Ying et al. publient la plus grosse série, sur 51 patientes et 57 nodules, avec un suivi de l'efficacité à 4 ans.[14] Les données allaient dans le même sens que les études précédentes : réduction de l'EVA de 5,5 à 1 à 6mois et 0 à 12 mois, une réduction du volume de 81,6 % à 6 mois et 100 % à 48 mois. Il y avait eu une seule complication majeure (brûlure au premier degré) et 2 récidives à 4 ans. Ainsi, les HIFU peuvent se faire sous contrôle échographique ou IRM et présentent de nombreux avantages : simple sédation, pas de pertes sanguines, pas de nouvelle cicatrice, pas de risque de dissémination de cellules et des suites plus simples avec une bonne efficacité ce qui en fait une alternative séduisante à la chirurgie.[15] Cependant l'accès aux HIFU est limité notamment par le coût de l'installation et ce traitement ne permet pas d'analyse histologique de la pièce opératoire. À notre connaissance aucune équipe ne dispose à ce jour de la technologie HIFU pour le traitement des endométrioses pariétales en France.
Endométriose profonde postérieure et HIFU Il existe à ce jour très peu d'essai rapportant des propositions de traitement mini-invasifs dans l'endométriose profonde postérieure. L'équipe de la Croix-Rousse à Lyon a publié en 2018 la description d'une technique de traitement des lésions d'endométriose recto-sigmoïdienne par HIFU. [16] Le protocole rapporté utilisait la sonde FocalOne® développée par l'entreprise EDAP-TMS (Vaulx-en-Velin, France) pour le traitement du cancer de la prostate. Il s'agit d'une sonde transrectale muni d'un transducteur diagnostique (sonde d'échographie) permettant la visualisation et le repérage de la lésion et d'un transducteur HIFU permettant le traitement semi-automatisé de la lésion d'endométriose. Le traitement est réalisé sous rachianesthésie, la patiente est en décubitus latéral droit. (Figure 2). La première étude de phase I sur 23 patientes, montrait une faisabilité du traitement de 83 % (n=20) et l'absence d'effet indésirable grave lié au traitement avec une durée moyenne de 56 minutes de traitement et une hospitalisation de 24 h. Les auteurs rapportaient une diminution non significative du volume des lésions, mais il existait une amélioration significative de l'EVA des symptômes gynécologiques et digestifs (dysménorrhée, dyspareunie, diarrhée, constipation, dyschesie, faux besoin et douleur pelvienne postérieure), ainsi qu'une amélioration significative de la qualité de vie (MOS-SF-36) à 1, 3 et 6 mois post-traitement. Une seconde étude de phase 2 (ENDO-HIFU-R1), multicentrique et sur un effectif plus important (n=38) a été menée afin de confirmer l'efficacité sur les symptômes et la qualité de vie ainsi que pour mieux évaluer l'impact du traitement sur les lésions en imagerie (NCT04494568). Dans cette étude, à la différence de la première étude de faisabilité qui incluait des lésions rectales ou sigmoïdiennes basses, l'inclusion était limitée à l'existence d'une atteinte rectale avec infiltration de la musculeuse. Les lésions rectales uniques associées à des lésions du torus et débordant parfois sur les ligaments utéro-sacrés et/ou le cul de sac vaginal postérieur pouvaient être inclues et traitées si possible dans leur totalité. Les inclusions ont été terminées en mars 2022 et les résultats de cette étude devraient être disponibles rapidement. La possibilité d'un traitement de la portion extra-digestive de certaines lésions laisse entrevoir la possibilité d'études ultérieures pour le traitement spécifique de ces lésions d'endométriose profonde postérieure du torus, du vagin ou des ligaments utérosacrés par HIFU et ce d'autant plus que le dispositif Focal One® est doté d'un logiciel de fusion IRM/écho qui permet d'envisager le traitement de lésions de petites tailles même si elles sont difficiles à repérer en échographie.

Figure 2 Installation pour le traitement d'un nodule d'endométriose rectal par HIFU. Sur l'image de gauche on voit la patiente en décubitus latéral droit avec la sonde de FocalOne® en place. Le chirurgien contrôle le traitement sur la console numérique. Sur l'image de droite on voit l'aspect échographique du nodule qui est délimité par les points bleu sombre. Les points verts sont les futurs cibles et les points rouges sont les zones déjà traitées.
Adénomyose et HIFU Il existe aujourd'hui plusieurs publications avec un nombre assez important de patientes rapportant l'efficacité des HIFU dans l'adénomyose. Dans cette indication, comme pour l'endométriose pariétale, les publications chinoises sont les plus nombreuses en lien avec le dispositif médical de la firme HAIFU®. Yang et al. sont les premiers à avoir initié en 2002 une étude clinique sur le traitement de lésions d'adénomyose en HIFU, qu'ils ont publié en 2009. Ils ont alors démontré la possibilité de créer des lésions HIFU avant hystérectomie pour adénomyose focale chez 30 patientes, en utilisant une sonde abdominale de 20 mm de diamètre produite par la firme HAIFU® qui pouvait venir directement au contact de l'utérus.9 En 2008, Fukunishi et al. rapportaient le traitement de 20 patientes avec une adénomyose à l'aide d'un appareil HIFU guidé par IRM, avec une amélioration significative des symptômes à 6 mois.[17] L'équipe de Zhou et a.l ont quant-à-eux évalué dans le même temps l'efficacité d'un traitement transpariétal en utilisant un appareil HIFU échoguidé chez 78 patientes présentant une adénomyose avec dysménorrhées et ménorragies. Avec un suivi médian de 24 mois pour 69 patientes, ils rapportaient une amélioration des symptômes chez 89,9 % des patientes (n=62).18 Dans cette étude, une IRM réalisée à J1 montrait des lésions de nécrose de coagulation chez 87 % des patientes avec 68 % des patientes qui présentaient un ratio de déperfusions de la lésion d'adénomyose supérieur à 50 %.[18] Le traitement HIFU était bien supporté en dehors de douleurs légères dont l'EVA restait inférieure à 4 et aucun événement indésirable grave n'était rapporté. Une équipe coréenne rapporte également une très importante étude rétrospective sur 346 patientes traitées pour adénomyose dans un seul centre, montrant une amélioration symptomatique à 12 mois chez près de 60 % des patientes avec une amélioration significative de la qualité de vie globale.[19] Plusieurs équipes se sont intéressées aux facteurs prédictifs de l'efficacité de la procédure. Dans leur série de plus de 208 patientes suivies pendant un minimum de 40 mois, Liu et al. montrent que le ratio de Volume Non Perfusé (NPV) post-traitement est corrélé comme l'âge au taux d'efficacité de la procédure à long terme.[20] De même, Zhang et al. ont montré que les patientes présentant une adénomyose focale répondaient significativement mieux que celles présentant une adénomyose diffuse en IRM.[21] Concernant la sécurité et la tolérance du traitement, les principales complications graves rapportées concernaient des brulures cutanées et des atteintes neurologiques des racines sacrées (principalement des douleurs du sacrum et une hypoesthésie ou des douleurs des membres inférieurs).[17, 18] Toutefois, avec l'amélioration du matériel et l'expertise des praticiens, le taux de complication rapporté dans la littérature semble diminuer fortement dans les grandes séries récentes. Ainsi, Liu et al. et Lee et al. rapportent un taux de complications graves inférieur à 1 % des procédures, avec pour la grande majorité une disparition spontanée dans les 2 semaines suivant le traitement.[19, 20] La société HAIFU® (Chongqing, China) rapporte le traitement de 10 310 patientes pour adénomyose entre 2011 et 2015 avec son modèle « JC », pour un taux de complication global de 23 % des patientes traitées. L'analyse de ces effets secondaires retrouve des douleurs pelviennes dans 22 % des cas, des pertes vaginales dans 11 % des cas et des douleurs sacrées dans 6 % des cas. Sur l'ensemble des patientes, 13 (0,1 %) ont rapporté un déficit sensitif et/ou d'une douleur d'un membre inférieur, qui se sont résorbés spontanément pour l'ensemble d'entre elles entre 2 semaines et 2 mois après le traitement. Il est également rapporté 21 brulures cutanées (0.2 %) et 2 plaies digestives (0.02 %), classées comme les complications les plus graves, les 2 dernières ayant nécessité une intervention chirurgicale.[22] Les lésions d'adénomyose postérieures, difficilement accessibles au traitement HIFU transpariétal, pourraient également être accessibles par voie transrectale grâce à l'utilisation du dispositif FocalOne.
Conclusion Ces dernières années, nous avons vu la prise en charge de l'endométriose s'orienter vers une désescalade chirurgicale visant tout d'abord à limiter le nombre de chirurgie et à favoriser la cœlioscopie ou la chirurgie robot assistée afin de limiter l'impact de ces traitements et simplifier les suites post-opératoires. Plusieurs équipes proposent actuellement des traitements encore moins invasifs permettant l'ablation de lésions d'endométriose par voie percutanée ou endoscopique, le plus souvent sans nécessité d'ouverture cutanée ou de la cavité abdominale. Les HIFU sont un exemple prometteur de traitement mini-invasif utilisable dans l'endométriose et dans l'adénomyose, qui est probablement la moins invasive de toutes les techniques mini-invasives puisqu'elle permet le traitement de lésion située en profondeur sans aucune plaie ou cicatrice en surface ou sur le trajet des ultrasons. Bien que des données de haut niveau de preuve soient indispensables pour valider l'utilisation des HIFU en routine dans l'endométriose et l'adénomyose, les données scientifiques disponibles sont déjà très encourageantes et laissent imaginer une véritable place pour ces techniques dans cette indication entre le traitement médical et la chirurgie conventionnelle. Les HIFU ne remplaceront pas plus que la chirurgie le traitement médical qui est le seul à limiter l'aggravation de la maladie et à prévenir la récidive, de même qu'ils n'ont pas vocation à remplacer totalement la chirurgie conventionnelle qui reste la seule option dans certaine localisation ou en cas d'échec du traitement HIFU. En revanche, du fait d'une efficacité spectaculaire sur les symptômes et d'un nombre relativement faible de complications, il semble logique que cette technique trouve sa place en 1re intention lorsqu'elle est possible après échec du traitement médical et avant d'envisager une chirurgie « conventionnelle » en particulier chez les femmes jeunes ou avec un projet obstétrical, pour limiter les gestes délabrants. L'absence d'étude de haut niveau de preuve est aujourd'hui l'un des derniers freins à la diffusion à large échelle des HIFU. Une réflexion doit cependant être entreprise sur les moyens d'obtenir la validation scientifique de cette technique, alors qu'elle a été développée comme alternative à la chirurgie pour en éviter les complications et qu'elle est vue par les patientes comme un moyen « moins risqué » par les patientes. Le risque de proposer des études randomisées comparant ces traitements à la chirurgie conventionnelle serait de se heurter à une difficulté d'inclusion ; les patientes préférant se contenter d'un traitement médical quitte à supporter des douleurs plutôt que de se confronter à une chirurgie « conventionnelle » et ses risques de complications ou de séquelles. À l'inverse, l'absence d'étude randomisée risque d'enfermer les HIFU dans le domaine des « traitements alternatifs » au même titre que certaines techniques de soins de support dont l'efficacité reste débattue. Dans l'attente d'un traitement médicamenteux curatif, qu'il soit basé sur l'immunothérapie ou de type thérapie ciblée, les HIFU restent l'une des options les plus séduisantes pour traiter les lésions d'endométriose profonde résistantes aux traitements hormonaux actuels. Le développement de cette technique pourrait avoir un impact majeur sur la réduction du taux de chirurgie invasive pour endométriose dans les prochaines années.

