Immunothérapies et JAK inhibiteurs dans la polyarthrite rhumatoïde

Laurene Bernard
Unité d'immunologie clinique et de Thérapeutique des maladies ostéo-articulaires Hôpital Lapeyronie, CHRU Montpellier.

Yves-Marie Pers
Inserm U1183, IRMB, University Hospital Saint Eloi, Montpellier

Résumé Le pronostic de la polyarthrite rhumatoïde (PR) a été complètement bouleversé ces trente dernières années avec l'arrivée des biothérapies et plus récemment des JAK inhibiteurs. Ces traitements agissent en ciblant les molécules inflammatoires ou les voies de signalisation intra-cellulaire impliquées dans la physiopathologie de la PR, avec comme principale contrainte une augmentation du risque infectieux.
Liens d'intérêt Les auteurs déclarent ne pas avoir de liens d'intérêts en relation avec cet article.
Mots clés Polyarthrite rhumatoïde, disease-modifying anti-rheumatic drugs, JAK inhibiteur, apprentissage machine, intelligence artificielle, médecine personnalisée. Introduction La polyarthrite rhumatoïde (PR) est une maladie auto-immune multifactorielle d'étiologie indéterminée touchant préférentiellement l'appareil ostéoarticulaire, à l'origine de destructions articulaires. La PR est également associée à des atteintes extra articulaires notamment cardiaque, pulmonaire, digestive, rénale, cutanée[1]. La prise en charge complexe, doit être multidisciplinaire et pensée dans sa globalité. La stratégie thérapeutique comprend des traitements médicamenteux mais aussi non pharmacologiques : éducation thérapeutique, réadaptation fonctionnelle, chirurgie et soutien psychologique [2]. Les traitements de fond ont pour but de diminuer les douleurs et gonflements articulaires, prévenir les déformations et destructions osseuses, maintenir la qualité de vie et contrôler les manifestations extra articulaires. Les résultats les plus probants ont été obtenus depuis le développement des disease-modifying anti-rheumatic drugs (DMARD), parmi lesquels on distingue les DMARDs conventionnels (csDMARD), biologiques (bDMARD) et synthétiques ciblés (tsDMARD). Cette dernière catégorie définit une nouvelle classe de DMARDs non biologiques. La prise en charge est bien codifiée avec des recommandations nationales et internationales régulièrement actualisées[3].
Approche thérapeutique Principes de prise en charge : Treat to Target La stratégie thérapeutique dans la PR repose sur le principe du « Treat to Target ». Cette approche repose sur l'établissement d'un diagnostic précoce permettant l'introduction rapide d'un traitement ciblé. L'objectif de cette stratégie thérapeutique est d'obtenir la rémission dans la PR, et d'éviter l'apparition de destructions articulaires. L'établissement du diagnostic de la PR repose sur des critères cliniques : synovite, durée d'évolution ; immunologiques : facteur rhumatoïde (FR), anticorps antipeptides citrullinés (ACPA) ; biologiques : syndrome inflammatoire[4]. Ensuite, l'introduction rapide d'un traitement de fond, avec comme chef de file le méthotrexate, combinée à un suivi régulier est nécessaire. Au bout de 3 à 6 mois, si l'objectif thérapeutique n'est pas atteint (rémission clinique ou faible niveau d'activité et absence de progression structurale), la stratégie doit être revue. En cas de facteurs de mauvais pronostic tels qu'une activité élevée de la maladie, des FR ou ACPA positifs ou des lésions érosives précoces, une intensification du traitement avec introduction d'un DMARD biologique ou synthétique ciblé associé au méthotrexate (ou autre csDMARD) est préconisée. En l'absence de ces facteurs, en première intention, il peut être proposé au patient d'effectuer un relais par un autre csDMARD ou une association de csDMARD[3]. Lors de cette adaptation, le contrôle étroit de la maladie reste nécessaire tant que la maladie est active.
Traitements biologiques Le développement des bDMARD a révolutionné le traitement de la PR ces trente dernières années. Environ 30 à 50 % des patients n'obtiennent pas une réponse satisfaisante au traitement par csDMARD. Dans ce cas, un relais par biothérapie doit être considéré. Les bDMARD sont des anticorps ciblant des voies de signalisation inflammatoires ou immunologiques. L'ensemble de ces molécules n'est disponible que par voie injectable (intraveineuse ou sous-cutanée). Les bDMARD ne peuvent pas être combinés entreeux mais ils sont le plus souvent associés aux csDMARD [5]. Les bDMARD se distinguent selon leur mécanisme d'action. ⺠L'infliximab, l'etanercept, l'adalimumab, le golimumab et le certolizumab pegol sont des anticorps monoclonaux ou des récepteur-antagonistes inhibant la voie du tumor necrosis factor (TNF)-α, une cytokine majeure impliquée dans la physiopathologie de la PR. Contrairement aux autres, l'etanercept n'est pas un anticorps monoclonal, mais un récepteur soluble du TNF qui inhibe compétitivement la liaison du TNF à ses récepteurs de surface. ⺠L'abatacept inhibe l'activation (co-stimulation) des lymphocytes T via leur protéine membranaire CD80/CD86. ⺠Le rituximab est un anticorps monoclonal ciblant le CD20 à la surface des lymphocytes induisant une déplétion profonde des lymphocytes B. ⺠Les inhibiteurs de récepteur à l'interleukine 6 (tocilizumab et sarilumab) ⺠Les antagonistes du récepteur à l'interleukine[1] (anakinra). Cette dernière classe n'est plus utilisée dans le traitement de la PR car les effets cliniques sont moindres comparativement aux autres traitements. En interférant avec le système immunitaire, tous les bDMARD augmentent le risque d'infection communautaire mais aussi aux agents tuberculeux et fongiques[6] (tableau). L'augmentation du risque infectieux nécessite une mise à jour complète des vaccinations avant l'initiation de ces thérapies. Les réactions à l'injection sont possibles mais modérées. Ces traitements biologiques sont très efficaces mais engendrent un coût non négligeable. Pour diminuer ce coût, des traitements biosimilaires ont été développés. Il s'agit de molécules partageant la séquence d'acides aminés avec le traitement de référence mais qui ne sont pas strictement identiques au traitement princeps. Les stratégies intégrant les biosimilaires s'avèrent aujourd'hui les moins coûteuses et tendent également à être parmi les plus efficaces[7]. Traitements de fond de synthèse ciblés Les targeted synthetic DMARDs (tsDMARDs) constituent une nouvelle classe thérapeutique dans le traitement de la PR. Contrairement aux bDMARDs qui ciblent spécifiquement des cytokines, les inhibiteurs des janus kinases (JAKi) ciblent la voie JAK/STAT, l'une des voies de signalisation les plus importantes. Elle n'est pas seulement impliquée dans l'inflammation mais aussi dans la prolifération cellulaire, la différenciation, l'apoptose et l'immunorégulation. Elle est divisée en trois parties : un récepteur transmembranaire, JAK et STAT. La liaison du ligand au récepteur active l'enzyme JAK, qui phosphoryle la protéine STAT, qui induit une cascade de transduction, régulant ainsi la transcription de gènes cibles[8] (figure). Les quatre molécules autorisées sont le tofacitinib, le baricitinib, l'upadacitinib et le filgotinib[3,9-12]. Ces traitements présentent l'avantage d'être disponibles par voie orale. Ils ont démontré leur efficacité dans différentes catégories de patients atteints de PR, qu'ils soient naïfs de traitement ou en échec de bDMARD. De plus, ils sont aussi efficaces en monothérapie ou associés à des csDMARD autres que le méthotrexate. Ces résultats, ont conduit, en 2020, à l'actualisation des recommandations européennes avec un positionnement des JAKi en première ligne après le méthotrexate, au même titre que les bDMARD[13]. La tolérance des JAKi est globalement bonne. Ils présentent un risque absolu d'événements indésirables similaire aux bDMARD. Cependant, il existe des effets indésirables potentiels incluant les neutropénies, les infections, l'insuffisance rénale, l'anémie, les troubles du métabolisme hépatique et lipidique, une élévation des créatine phosphokinases (CPK)[14]. Récemment, leur profil de tolérance a été revu à la suite de l'étude ORAL SURVEILLANCE. Celle-ci étudiait la tolérance du tofacitinib par rapport aux anti-TNF (Adalimumab ou Etanercept) dans une population de sujets de plus de 50 ans ayant au moins un facteur de risque cardiovasculaire. Un surrisque d'événement thromboembolique veineux et artériel de même que la survenue de cancers, notamment du poumon et de lymphome, ont été constatés dans le bras tofacitinib[15] (tableau).
Certaines données en vie réelle suggèrent aussi une augmentation du risque thromboembolique veineux et artériel avec les JAKi[16]. À la lumière de ces nouvelles données, le positionnement des JAKi dans leur stratégie d'utilisation a été modifié. Désormais, si l'objectif thérapeutique n'est pas atteint sous csDMARD, en présence de facteurs pronostiques défavorables, un traitement par bDMARD est préféré. Les JAKi peuvent être considérés en tenant compte de certains facteurs de risque : un âge supérieur à 65 ans, un tabagisme actuel ou sevré et les autres facteurs de risque cardiovasculaires, néoplasiques ou thromboembolique[3]. Malgré la survenue de ces événements, il ne faut pas perdre de vue que cette nouvelle classe thérapeutique présente de nombreux avantages et une efficacité certaine. Grâce à la stratification des risques, un choix raisonné et une décision partagée avec le patient, les JAKi gardent une place de choix dans le traitement de la PR. Nouvelles perspectives dans le traitement de la PR Médecine prédictive L'identification précoce des sujets non-symptomatiques mais à risque de développer la PR est une des prochaines étapes dans la gestion de cette maladie. Pour y parvenir, l'analyse des données multi-omiques (génomique, transcriptomique, protéomique…) est prometteuse pour établir le phénotype des futurs malades. Pour affiner le profil de ces individus, ces informations pourront être couplées à celles d'autres biomarqueurs via l'intelligence artificielle (IA). Dépister précocement les personnes susceptibles de développer une PR grâce à ces outils, permettra de prendre des mesures précoces pour minimiser le risque d'évolution vers la maladie et de préserver l'état de santé le plus longtemps possible[17]. Personnalisation des traitements Si, en dépit de la mise en place de mesures préventives adaptées chez des patients précocement identifiés, l'évolution est défavorable, alors il faut pouvoir proposer une médecine personnalisée. Disposer d'indicateurs ou biomarqueurs pour prédire la réponse au traitement par cs DMARD ou bDMARD serait très utile. On peut espérer, qu'avec le développement de l'IA, nous en soyons capables. Les algorithmes d'apprentissage machine (« machine learning ») aident à la conception de modèles prédictifs capables, notamment, de prédire une réponse spécifique à un traitement. Par exemple, différents modèles de prédiction ont été proposés pour prédire le risque de poussée chez les patients qui interrompaient leur traitement par DMARD[17-19].
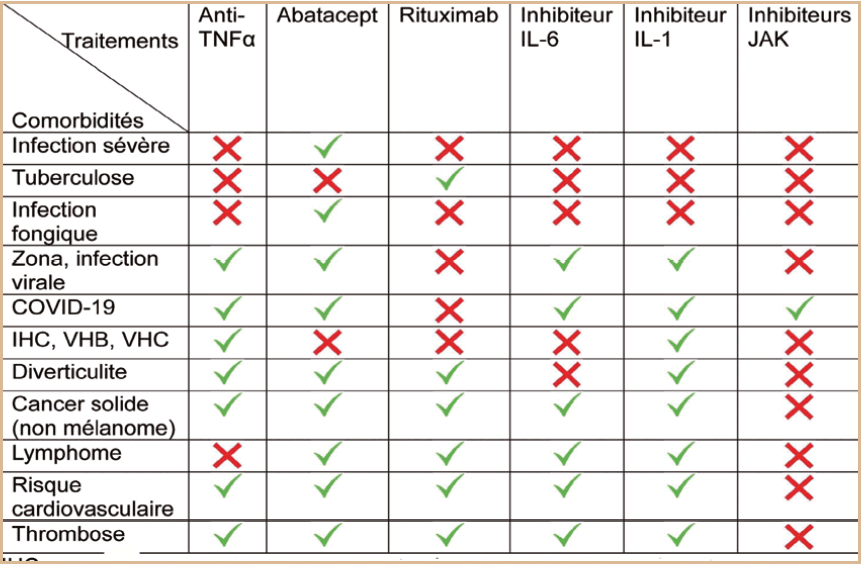
â² Tableau : profil de sécurité des biothérapies et JAK inhibiteurs IHC : insuffisance hépato cellulaire, VHB : virus de l'hépatite B, VHC : virus de l'hépatite C.
Nouvelles cibles Dans les maladies auto-immunes, il existe une perte de la tolérance vis-à-vis des antigènes du soi. Ainsi, le développement d'immunothérapies restaurant cette tolérance permettrait de contrôler et supprimer les lymphocytes T (LT) auto-réactifs. Les cellules dendritiques (CD) sont essentielles pour l'induction et la maintenance de la tolérance immunitaire. La vaccination par des CD autologues modifiées avec un inhibiteur de NF-κB exposées à quatre peptides citrullinés ont permis d'obtenir une augmentation des LT régulateurs et une diminution des LT auto-réactifs [20]. La distribution spécifique au niveau de l'articulation enflammée de molécules via un transporteur offre la possibilité d'optimiser l'efficacité des traitements et de s'affranchir de leurs effets secondaires systémiques. Une première piste consiste à utiliser les nanoparticules, de très fines particules dont le diamètre varie entre 1 et 1000 nm. L'utilisation des cellules souches mésenchymateuses (CSM) comme véhicule représente une alternative prometteuse. Ces cellules possèdent des propriétés anti-inflammatoires (sécrétion d'exosomes, de cytokines et facteurs de croissance) et ont la capacité de migrer sur les sites inflammatoires. Par exemple, une molécule anti-inflammatoire, telle que le méthotrexate, pourrait être chargée dans une nanoparticule puis conjuguée à la surface des CSM aboutissant à uneimmunosuppression renforcée et ciblée [21].
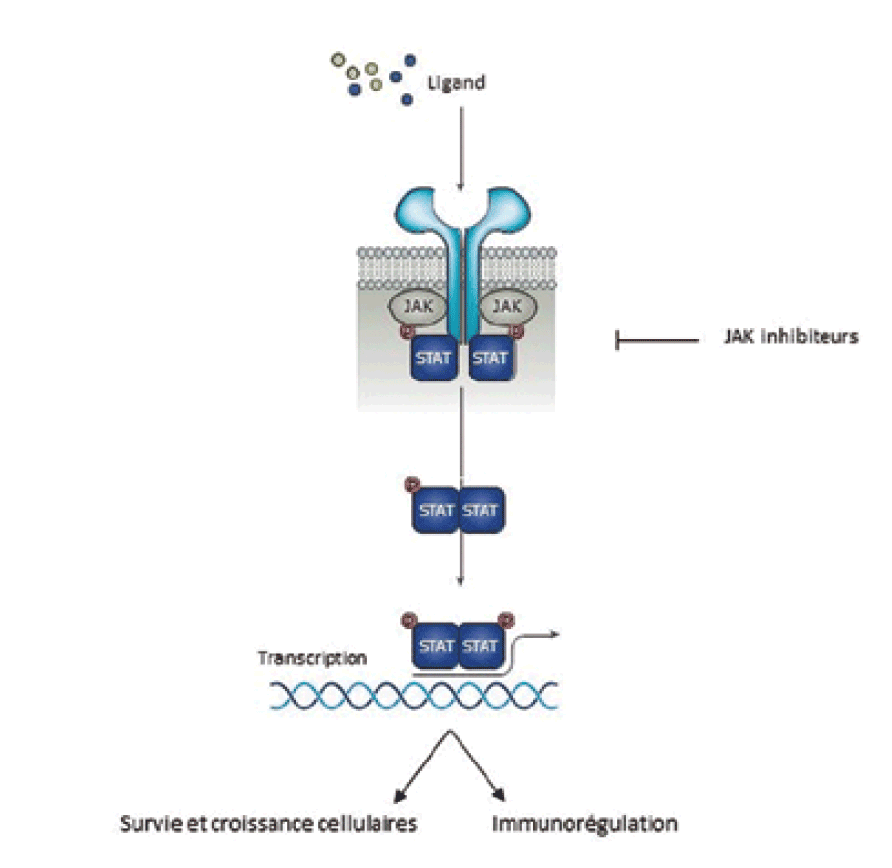
â² Figure : vue d'ensemble de la voie de signalisation JAK/STAT.
Conclusion La prise en charge de la PR est en constante évolution. De nos jours, l'approche thérapeutique tend vers une médecine de précision et personnalisée. Celle-ci pourra s'appuyer sur le développement de nouvelles molécules sans oublier l'apport des nouvelles technologies