DMLA : Up to date en 2022

Liens d'intérêts consultant pour Novartis, Bayer, Abbvie, Horus, Appelis.
Contexte La dégénérescence maculaire liée à l'âge (DMLA) est une maladie fréquente du sujet âgé, source de handicap visuel grave. C'est une pathologie complexe, multi factorielle, impliquant le vieillissement rétinien ainsi que la conjonction de facteurs environnementaux et génétiques. Elle concernerait 7,1 % des plus de 75 ans[1] et toucheraient en France, environ 1,5 million de personnes.
Outils diagnostics : une précision quasi histologique et de moins en moins invasive Le diagnostic et le suivi des différentes formes de DMLA ont bénéficié d'avancées majeures dans le domaine de l'imagerie chorio-rétinienne.
Le fond d'œil, ou la rétino-photographie, reste l'examen le plus simple et de première intention lorsqu'une DMLA est suspectée. La qualité des clichés du fond d'œil s'est nettement améliorée ces dernières années. La plupart des appareils permettent de réaliser des clichés non mydriatiques, c'est-à-dire sans dilatation pupillaire. Des modifications de la pigmentation maculaire ou la présence d'hémorragies peuvent évoquer une DMLA (Figure 1).
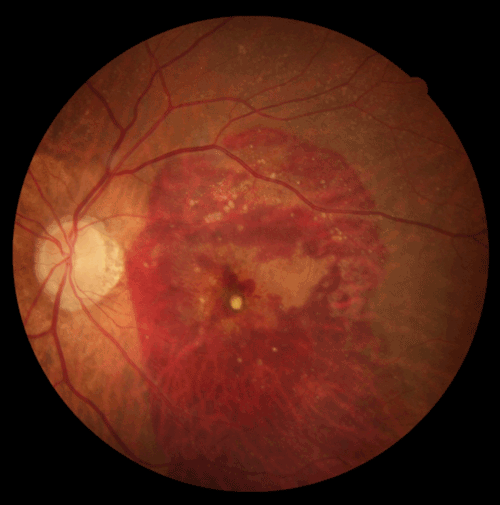
Figure 1 Rétinophoto montrant une DMLA exsudative avec hémorragie rétinienne
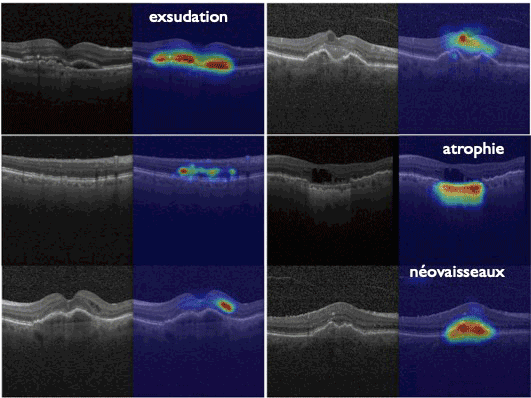
L'OCT (Tomographie en cohérence optique) est l'examen clé dans le diagnostic et le suivi des patients. Cet examen repose sur un balayage rétinien par une lumière proche de l'infrarouge et offre une reconstruction immédiate et quasi histologique des tissus chorio-rétiniens, avec une résolution axiale de l'ordre de 3-5 ym pour les dernières générations d'OCT (Spectral-domain OCT, Swept source OCT) (Figure 2). La DMLA peut être caractérisée par un soulèvement de l'épithélium pigmentaire rétinien, la présence d'une exsudation intra ou sous-rétinienne et/ou des zones d'atrophie rétinienne. Les zones pathologiques peuvent être analysées et comparées qualitativement et quantitativement au cours du suivi avec précision grâce au système d'Eye-Tracking.
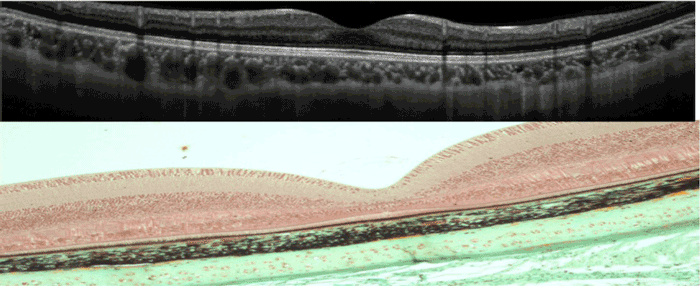
Figure 2 Tomographie en cohérence optique. En haut, image OCT normale avec les différentes couches chorio-rétiniennes. En bas, image histologique de la rétine.
La DMLA exsudative est liée à la présence d'une néovascularisation anormale choroïdienne ou rétinienne externe et son cortège de conséquences : hémorragies, exsudation, fibrose, etc. Classiquement, un moyen de visualiser cette néovascularisation est la pratique d'une angiographie rétinienne à la fluorescéine et/ou en ICG pour les néovaisseaux sous épithéliaux (ou type 1). Toutefois cet examen est inconfortable (éblouissements) et invasif puisqu'il existe un risque allergique. L'OCT-angiographie (OCTA) offre une possibilité de diagnostiquer ces néovaisseaux en s'affranchissant du recours à l'injection intraveineuse d'un colorant. Cette technologie repose sur l'acquisition très rapide de deux OCT successives et de la détection des éléments en mouvement au sein des tissus chorio-rétiniens. Les seules structures en mouvement étant les éléments figurés du sang, on visualise ainsi les vaisseaux normaux et pathologiques chorio-rétiniens (Figure 3). Toutefois, cette technique n'est pas fiable à 100 % puisqu'il existe parfois des artéfacts. Sa sensibilité est d'environ 85 % dans les néovaisseaux de type 1 ou sous épithéliaux[2]. Elle est plus élevée dans les néovaisseaux de type 2 (ou pré-épithéliaux) et les type 3 (ou intra-rétiniens). Généralement, les angiographies rétiniennes à la fluorescéine et en ICG sont réalisées actuellement en cas de doute sur une néovascularisation en OCTA.
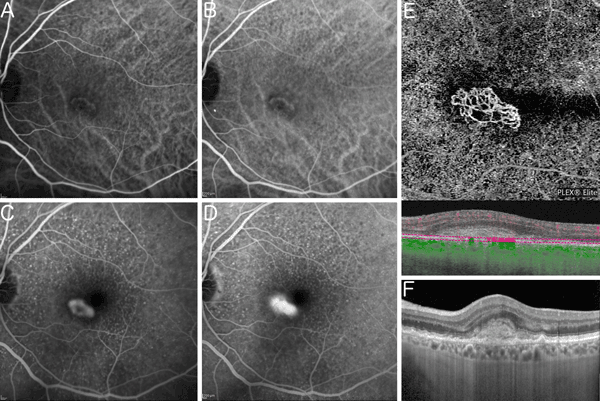
Figure 3 Néovaisseaux de type 2 en imagerie multimodale. Angiographie en ICG au temps précoce (A) et tardif (B). Angiographie à la fluorescéine au temps précoce (C) et tardif (D). Le lasci néovasculaire est bien visible avec une diffusion tardive du colorant. Même lésion en OCT angiographie (E) et en OCT classique (F). La lésion néovasculaire est visualisable au niveau de la rétine externe sans injection de colorant.
Classification et nouvelles formes cliniques dans la DMLA exsudative Classiquement, il existe 3 formes de néovascularisation[3]. Dans la néovascularisation maculaire de type 1 (anciennement « occulte » ou sous épithéliale), les néovaisseaux sont situés sous l'épithélium pigmentaire rétinien. Dans la type 2 (anciennement « visible » ou pré-épithéliale) ces derniers sont situés au-dessus de l'épithelium pigmentaire, au contact de la rétine neuro-sensorielle. Enfin dans la type 3 (anciennement anastomose chorio-rétinienne ou prolifération angiomateuse rétinienne) elle se situe au sein de la rétine neuro-sensorielle avec une extension vers les vaisseaux choroïdiens. Ces différents néovaisseaux peuvent se combiner entre eux et donner des formes mixtes.
De nouvelles formes cliniques ont été décrites ces dernières années. Parmi elles nous pouvons citer la néovascularisation quiescente[4] (de type 1, sans exsudation et ne nécessitant une surveillance resserrée), ou les nascent type 3[5] (type 3 uniquement localisé en intra-rétinien sans exsudation) qui doivent également faire l'objet d'une surveillance attentive. La DMLA atrophique a également fait l'objet d'une nouvelle classification basée sur l'OCT selon que l'atteinte atrophique touche uniquement les photorécepteurs ou également l'épithélium pigmentaire et selon que cette dernière soit complète (continue) ou non[6].
Traitements actuels et à venir Il existe actuellement des traitement approuvés uniquement dans la forme exsudative. Il s'agit d'un traitement anti-angiogénique (anti-VEGF) administré par voie intra-vitréenne, qui vont limiter la croissance néovasculaire et son exsudation. Deux molécules ont l'AMM : le ranibizumab et l'aflibercept. Le bevacizumab est utilisé de façon marginale en Autorisation Temporaire d'Utilisation, par préparation pharmaceutique hospitalière. De nombreuses études ont conclu à la non infériorité des ces traitements. Un inconvénient majeur de cette thérapie, outre son caractère invasif, est la nécessité d'avoir recours à des injections répétées en raison de la récidive exsudative.
Pour cette raison, différents protocoles thérapeutiques ont été proposés. Le plus utilisé est le schéma dit « Pro ReNata » (PRN). Après 3 injections mensuelles dites d'induction, le patient est suivi habituellement toutes les 4 à 6 semaines avec une injection en cas de présence d'exsudation en OCT (caractérisée par la présence de fluide intra ou sous rétinien). Ce protocole est simple mais contraignant car les visites sont nombreuses. Des schéma dit « pro-actifs » se sont donc développés et ont gagné en popularité. Dans ces protocoles, le patient est traité systématiquement à chaque visite mais l'intervalle entre ces dernières sera progressivement ajusté en fonction des récidives exsudatives jusqu'à des délais pouvant excéder 12 semaines lorsque cela est possible. Il s'agit du protocole « Treat and extend ».
De nouvelles molécules sont attendues très prochainement dans la DMLA exsudative. La voie d'administration reste intra-vitréenne mais ces traitements ont démontré une meilleure efficacité anatomique sur l'exsudation et des durées d'action plus longues. Ainsi le brolucizumab est anti-VEGF de petite taille qui a déjà obtenu l'autorisation aux États-Unis, Canada et dans certains pays Européens avec des injections tous les 3 mois chez plus de la moitié des patients après la phase d'induction (études HAWK et HARRIER)[7]. Son lancement est retardé en France en raison de certains effets secondaires inflammatoires rétiniens rapportés. Le faricimab est une molécule bi-spécifique anti-VEGF et anti-Angiopoïétine. Les résultats des études de phase 3 ont montré son efficacité avec des intervalles de retraitement de 3 à 4 mois après la phase d'induction (études TENAYA et LUCERNE)[8]. Une AMM serait attendue courant 2023. L'aflibercept à haute dose est également développé et a montré des bons résultats préliminaires dans une étude de phase 2 (étude CANDELA)[9].
Une autre nouveauté attendue prochainement est la pose chirurgicale d'un réservoir intra-vitréen qui serait rechargé régulièrement (tous les 6 mois) et permettrait un relargage continu d'anti-VEGF. Dans l'étude de phase 3 ARCHWAY, seulement 1,6 % des patients ont nécessité des traitements supplémentaires par injection d'anti-VEGF[10]. Ce dispositif a obtenu l'autorisation de commercialisation par la FDA.
Enfin, une nouveauté de taille est le développement de la thérapie génique dans la DMLA exsudative permettant une expression de molécules anti-VEGF par les cellules rétiniennes. Différents modes d'administration des thérapies géniques rétiniennes ont été proposé : l'injection sous rétinienne, qui nécessite une chirurgie, l'injection supra-choroïdienne, moins invasive, et l'injection intra-vitréenne.
L'ADVM-022 est une thérapie génique qui va induire une production par les cellules cibles d'une protéine anti VEGF similaire à l'aflibercept. Elle est administrée par voie intra-vitréenne. Les patients pouvaient bénéficier d'IVT de secours d'anti-VEGF en cas d'activité exsudative. Les résultats ont retrouvé une diminution drastique du nombre d'IVT d'anti-VEGF de secours, soit -83 à -97 % d'IVT à 2 ans, selon le dosage administré, avec une bonne tolérance[11] (Figure 4).
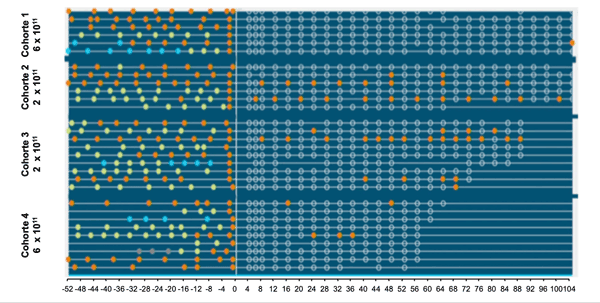
Figure 4 Thérapie génique. Les points colorés représentent les injections d'anti-VEGF. La barre verticale correspond à l'administration de la thérapie génique. On constate une diminution drastique du besoin en injections intra-vitréennes d'anti-VEGF après traitement.
Le RGX-314 est une thérapie génique ayant pour objectif la production par les cellules cibles d'une molécule anti-VEGF similaire au ranibizumab. L'étude AAVIATE a testé le RGX-314 par voie supra-choroïdienne, chez des patients non naïfs atteints de DMLA exsudative, à 5 dosages différents, avec des IVT de secours d'anti-VEGF possibles. Les premiers résultats à 6 mois confirment l'efficacité avec une diminution de -71,8 % à -75,9 % des IVT nécessaires[12]. Ces résultats ont marqué la communauté ophtalmologique et des larges études sont déjà programmées.
Intelligence artificielle Comme d'autres nombreuses spécialités, l'ophtalmologie a bénéficié des avancées de l'intelligence artificielle. Différents algorithmes ont été développés, qui permettent un dépistage efficace à partir de rétinophoto. D'autres algorithmes analysent l'OCT et offrent une segmentation automatisée des couches rétiniennes, une détection et une classification des lésions ainsi qu'une évaluation de l'exsudation. Certains algorithmes vont plus loin et proposent une projection évolutive des lésions atrophiques, des besoins thérapeutiques et des résultats fonctionnels[13]. Ces outils sont en pleine expansion et devraient prochainement être intégrés dans la pratique quotidienne.
DMLA atrophique : le parent pauvre ? Malgré des efforts de recherche considérables, il n'existe actuellement pas de traitement approuvé dans la DMLA atrophique. La molécule la plus avancée est le pegcetacoplan. Administré en intravitréen tous les mois, ce traitement a démontré un ralentissement de l'évolution des lésions dans des études de phase 3 (études DERBY et OAKS). Il s'agit d'un anti-inflammatoire agissant sur la voie du complément en inhibant le C5[14]. D'autres voies thérapeutiques prometteuses existent telles que les implants de cellules souches.
Conclusion La DMLA reste donc en 2022 une cause majeure d'handicap visuel. Les traitements actuels ne permettent pas une guérison mais un contrôle des lésions et de leur activité. L'évolution est souvent péjorative, en raison de l'apparition d'une fibrose retienne ou d'atrophie. L'avenir proche est molécules à durée d'action plus longue et à la thérapie génique. L'intelligence artificielle permet un dépistage plus précoce et une personnalisation des schéma thérapeutiques.