Comparaison des propriétés des IL-17A et F et de l'IL-23 : implications thérapeutiques

Marie Robert
Unité de recherche immunogénomique et inflammation, Hôpital Edouard Herriot, Hospices Civils de Lyon.

Pierre Miossec
Unité de recherche immunogénomique et inflammation, Hôpital Edouard Herriot, Hospices Civils de Lyon.

Résumé Les traitements ciblant les voies de l'IL-17 et de l'IL-23 ont révolutionné la prise en charge du psoriasis. En revanche, malgré des arguments forts pour un rôle pathogénique de ces cytokines, le bénéfice thérapeutique n'est pas toujours celui escompté notamment dans les spondylarthrites ou la polyarthrite rhumatoïde. Les interactions entre cellules immunes et stromales pourraient expliquer ces résultats surprenants.
Liens d'intérêt Les auteurs déclarent ne pas avoir de liens d'intérêts en relation avec cet article.
Mots clés Interleukine-17A, interleukine-17F, interleukine-23, fibroblastes, synoviocytes, spondylarthrite, psoriasis, rhumatisme psoriasique, polyarthrite rhumatoïde.
Introduction Le spectre des pathologies inflammatoires chroniques est très large et chacune d'elle est caractérisée par un environnement cytokinique différent. La mise en évidence tour à tour de l'interleukine (IL)-17A, puis de l'IL-23 et plus récemment de l'IL-17F a permis d'affiner notre compréhension de la physiopathologie de la polyarthrite rhumatoïde (PR), de la spondylarthrite (SpA), du psoriasis (Pso). Ces cytokines sont devenues la cible de thérapeutiques particulièrement efficaces notamment dans le Pso. Pour autant, malgré des arguments forts pour un rôle pathologique de ces cytokines, l'efficacité modeste des inhibiteurs de l'IL-17A et/ou de l'IL-23 dans la SpA ou la PR est surprenante et soulève un certain nombre de questions. La compréhension des différents effets de l'IL-17 et de l'IL-23 selon le tissu considéré et du rôle joué par les interactions entre cellules immunes et stromales permet d'esquisser un certain nombre de réponses à ces questions.
Physiopathologie Biologie de l'IL-17A et F et de l'IL-23 IL-17A et F L'interleukine (IL)-17 a été identifiée pour la première fois en 1993 sous le nom de CTLA8. Son activité biologique a été décrite trois ans plus tard avec la mise en évidence de la production d'IL-6 et d'IL-8 par les synoviocytes en présence d'IL-17 [1]. L'IL-17 a par la suite été renommée IL-17A et cinq autres cytokines (IL-17B à IL-17F) sont venues compléter la famille de l'IL-17. L'IL-17A et l'IL-17F sont les plus proches en termes de structure puisqu'elles partagent une homologie de 50 %. Elles peuvent être sécrétées sous la forme d'homodimères ou d'hétérodimères, avec une activité biologique pro-inflammatoire similaire bien que moindre pour l'IL-17F [2]. Les cellules productrices d'IL-17 sont essentiellement les lymphocytes T CD4 de type Th17 dont la différenciation se déroule en 3 étapes. Le TGF-ß et l'IL-21 permettent d'induire le facteur de transcription RORc, avant que l'IL-23R soit exprimé lors de la phase d'amplification sous l'action de l'IL-1ß et de l'IL-6, permettant ensuite la stabilisation de la différentiation par l'IL-23. Les lymphocytes Th17 sont capables de produire l'IL-17A, l'IL-17F, l'IL-21 et l'IL-22. Il existe une plasticité importante entre les lymphocytes Th17 et les lymphocytes T régulateurs (Treg) [3]. D'autres cellules immunitaires sont capables de produire de l'IL-17, telles que les lymphocytes T CD8, les lymphocytes γáµ¹ , ou encore des cellules de l'immunité innée (ex : cellules natural killer) [4].
Outre leurs rôles anti-infectieux contre les infections à bactéries extra-cellulaires et fongiques, l'IL-17A et l 'IL- 17F ont des effets pro inflammatoires. Elles se lient à un récepteur commun composé de deux sous unités (IL-17RA et IL-17RC), puis activent notamment la voie NFĸB et induisent la production de chémokines (ex : IL-8) et de cytokines pro-inflammatoires (ex : IL-6) surtout par les cellules stromales. Cet effet pro-inflammatoire est potentialisé par le TNF, avec qui il existe une synergie d'action [4].
IL-23 L'IL-23, décrite en 2003, est une cytokine appartenant à la famille de l'IL-12. L'IL-23 et l'IL-12 sont des hétérodimères composés d'une chaine commune p40, et d'une chaine p19 pour l'IL-23 et p35 pour l'IL-12. L'IL-23 est majoritairement produite par les cellules dendritiques, les monocytes et les macrophages. Elle module la différentiation Th17 (figure 1), favori sant ensuite la sécrétion de cytokines pro-inflammatoires telles que l'IL-17A, IL-17F et IL-22. L'activité biologique de l'IL-23 est secondaire à sa liaison à un récepteur composé de deux sous-unités : l'IL-23R et l'IL-12Rß1 (chaine commune au récepteur de l'IL-12), qui active ensuite les voies de signalisation JAK/STAT puis la sécrétion des cytokines mentionnées ci-dessus. L'IL-12, quant à elle, est d'avantage impliquée dans la différentiation Th1 [5, 6].
Interdépendance des voies de l'IL-17 et de l'IL-23 L' IL-2 3 module pour la différe ntia tion des lymphocytes Th17. En son absence, l'étape de stabilisation n'est pas assurée, laissant la place à une éventuelle modification de la balance Th17/Treg compte tenu de la plasticité de ces populations cellulaires [3] (figure 1). Cette interdépendance entre les voies de l'IL-17 et de l'IL-23 a notamment été démontrée dans les fibroblastes cutanés qui stimulent la sécrétion d'IL-23 par les cellules dendritiques, favorisant le développement de lymphocytes Th17 [7] .
Effets tissulaires et systémiques de l'IL -17 et de l' IL-2 3 Synoviocytes et ostéoblastes/ostéoclastes L'IL-17A, et dans une moindre mesure l'IL-17F, induisent la production de cytokines et chémokines proinflammatoires par les synoviocytes. Elles induisent aussi la production d'enzymes détruisant le cartilage, tout en permettant la prolifération et la migration des synoviocytes [2]. De façon intéressante, l'IL-17A et le TNF favorisent la formation osseuse à travers leurs effets sur les ostéoblastes lorsque ceux-ci sont étudiés isolément [8]. En revanche, lorsque l'effet de ces cytokines est étudié sur l'ensemble du tissu osseux, la destruction outrepasse la formation osseuse [9]. Ces résultats permettent d'expliquer les différences de remodelage osseux entre la PR et le PsA, caractérisés par une des truction osseuse, et la SpA, caractérisée par une format ion osseu se ab errante puisque les ostéoclastes sont absents du microenvironnement des syndesmophytes [10]. Bien q ue les effets de l'IL-23 sur les synoviocytes soient moins décrits, le niveau d'IL-23 dans le liquide synovial est associé à la présence de structures lymphoïdes ectopiques [11]. Des résultats suggèrent que l'IL-23 induirait également l'expression de RANKL par les synoviocytes [12].
Fibroblastes cutanés et kératinocytes L'IL-17A entraine la production de chémokines et de cytokines par les kératinocytes et les fibroblastes cutanés. Dans le cadre du Pso, 3 groupes de cytokines sont induits ; un grou pe permet tant le maintien de l'inflammation tissulair e (vi a l'IL-36 et l'IL-17C), un groupe responsable des altérations épidermiques avec un rôle clé joué par l'IL-20, un dernier groupe ave c l'IL-19 qui amplifie les e ffets de l'IL-17A [13]. Enfin, l'IL-17A en combinaison avec le TNFα induit la sécrétion d'IL-23 par les kératinocytes, qui permet ensuite le maintien de la différentiation Th17 [14].
Effets systémiques Outre ses effets locaux, l'IL-17A, ou plus largement l'axe IL-23/IL-17, possède des effets systémiques. Il est responsable d'athérosclérose accélérée, de fibrose hépatique, et d'une atteinte musculaire [15]. En effet, l'IL-17A induit in vitro un phénotype pro-coagulant et pro-thrombogène, que l'on constate chez les patients PR puisque ceux avec un niveau d'IL-17A plus élevé ont plus de risque de développer ultérieurement un évènement cardiovasculaire [16]. Ce phénomè ne es t sous-ten du au moins partiellement par l'effet combiné de l'IL-17A et du TNFα sur les hépatocytes qui i nduisent une élévation de la CRP, via la sécrétion d'IL-6, et dont la concentration est associée au risque CV [15, 17].
Comparaison des effets de l'IL-17A et F et de l'IL-23 L'utilisation de modèles de cocultures entre cellules immunitaires et stromales, synoviocytes ou fibroblastes cutanés permet de recréer la situation clinique, et de caractériser le rôle joué par chacune des cytokines et de leurs récepteurs.
Différences entre les fonctions de l'IL-17A et F et de l'IL-23 La signalisation de l'IL-17A et de l'IL-17F met en jeu le récepteur IL-17RA/RC alors que l' IL-23 se lie au récepteur IL-23R/IL-12Rß1. Le traitement de cocultures cellules immunitaires/synoviocytes par de l'IL-17F induit l'expression à la fois du récepteur de l'IL-17A et F, et du récepteur de l'IL-23. À l'inverse, l'IL-17A et l'IL-23 n'ont aucun effet sur l'expression de ces deux récepteurs. Le traitement de cocultures cellules immunitaires/fibroblastes cutanés par l'IL-17A et l'IL-17F induit l'expression du récepteur IL-17RA/RC. L'IL-17A et l'IL-23 favorisent l'expression des deux sous-unités du récepteur de l'IL-23 (IL-23R et IL-12Rß1) sans augmenter celle du récepteur de l'IL-12 (IL-12Rß2). À l'inverse, l'IL-17F augmente davantage l'expression du récepteur de l'IL-12 par rapport à celui de l'IL-23. Ceci suggère que les cocultures cellul es immunitaires/fibroblastes cutanés sont plus sensibles à l'IL-17A et à l'IL-17 F que les cocultures entre cellules immunitaire s/synoviocytes sont sensibles uniquement à l'IL-17F. Enfin, le rôle de l'IL-23 varie également selon le tissu considéré. Elle est nécessaire à la production de l'IL-17 au niveau cutané alors que cette dernière est produite directement au sein de la synoviale ou du tissu osseux [18]. Des données in vivo obtenues dans un modèle murin de psoriasis suggèrent un effet prédominant de l'IL-23 comparée à l'IL-17A [19].
Rôle des interactions entre cellules immunes et stromales La production d'IL-17 par les cellules immunitaires est augmentée par le contact avec les synoviocytes et les fibroblastes cutanés. En revanche, il existe une nette différence pour l'IL-23 dont la sécrétion est diminuée par l'interaction cellules immunitaires/synoviocytes alors qu'elle est augmentée lors de cocultures cellules im munitaires/fibro blastes cutanés. L'expression de l'IL-23 est augmentée par les interactions cellulaires, suggérant une consommation différente de cette cytokine selon l'origine des cellules stromales.
Plus encore, l'état d'activation des cellules stromales est impliqué dans la production de l'IL-17 et de l'IL-23 ainsi que de leurs récepteurs [20]. Aussi, les interactions entre cellules stromales et lymphocytes Th17 pourr aient être di ff érentes entre la peau et les enthèses [21]. Les interactions entre tissus osseux et cartilagineux modulent également le phénotype clinique et la balance résorption/formation osseuse qui diffère entre PR et SpA. En effet, l'absence d'ostéoclastes à l 'interface os/(fibro)-cartilage dans la SpA est associée à une augmentation de la formation osseuse au profit de la destruction. Les données disponibles concernent s urtout l' IL-17 et dans une moindre mesure l'IL-23 [21]. Ainsi, l'IL-17A, l'IL-17F et l'IL-23 ont des propriétés différentes selon le tissu considéré et leurs effets sont modulés par les interactions entre cellules immunes et stromales. Ces résultats apportent une ébauche de réponse aux efficacités différentes des inhibiteurs de ces cytokines selon les pathologies. La figure 2 résume ces différences entre synoviocytes et fibroblastes cutanés.
Efficacité clinique des inhibiteurs de l'IL-17A et F et de l'IL-23 Thérapeutiques disponibles Les inhibiteurs comme rcialisés des voies de l'IL-17 et de l'IL-23 sont actuellement des anticorps monoclonaux, d'autres molécules sont en cours de développement. Plusieurs inhibiteurs de la voie IL-17 ont été développés avec des cibles différentes. Le sécukinumab et l'ixékizumab ciblent l'IL-17A, le bimékizumab à l a fois IL-17A et IL-17F, le brodal umab l'IL-17RA. D'autres inhibiteurs sont en cours de développement, notamment pour juguler la synergie d'action entre IL-17 et TNFα [22]. Il existe des inhibiteurs spécifiques de l'IL-23 (sous-unité p19) tels que le guselkumab, le tildrakizumab et le risankizumab. L'ustékinumab cible la sous unité p40 commune à l'IL-12 et à l'IL-23 [22]. Ces inhibiteurs ont des efficacités différentes selon les pathologies considérées, qui peuvent être en partie sous-tendues par les éléments discutés plus haut.
Psoriasis et rhumatisme psoriasique L'utilisation des inhibiteurs de l'IL-17 et de l'IL-23 permet une nette amélioration, voire une disparition totale, des lésions de psoriasis chez la grande majorité des patients [13]. À noter que le bimékizumab a montré une meilleure efficacité que le sécukinumab dans le psoriasis modéré à sévère [23]. Il est possible que l'utilisation précoce de ces inhibiteurs permette également d'obtenir une rémission à long terme en prévenant le développement de cellules résidentes mémoires [13]. L'efficacité de ces molécules est relativement similaire dans le rhumatisme psoriasique [24].
Spondylarthrites Au sein des SpA, les inhibiteurs de l'IL-17 sont efficaces alors que les inhibiteurs de l'IL-23 ne le sont pas dans les SpA axiales. Ceci peut être expliqué par une production locale d'IL-17, ne requérant pas d'IL-23 [10]. Les inhibiteurs de l'IL-17 et de l'IL-23 sont en revanche efficaces dans les formes périphériques de SpA [25].
Polyarthrite rhumatoïde Au sein des inhibiteurs de l'IL-17, le sécukinumab a un effet bénéfique modeste et surtout hétérogène chez les patients atteints de PR comparé au placebo selon le critère de répo nse ACR20, et nul chez les patients non-répondeurs aux anti-TNFα [26]. En revanche, l'utilisation du bimékizumab semble prometteuse chez ces patients non-répondeurs aux anti-TNFα [27]. Les inhibiteurs de la voie de l'IL-23 ne sont pas efficaces chez les patients avec une PR active malgré du méthotrexate [28].
Optimisation des traitements Les inhibiteurs des voies de l'IL-17 et de l'IL-23 ont davantage été testés dans les PR réfractaires où ils ont démontré peu ou pas d'efficacité.Ils mériteraient d'être testés plus précocement puisque l'IL-17A apparait comme critique dans l'induction des anti-CCP [29]. Par ailleurs, identifier les patients via la mesure de l'IL-17A bioactive permettrait peut-être de sélectionner les malades pouvant bénéficier de ces inhibiteurs [30].
Conclusion Les cellules stromales répondent différemment aux cytokines selon qu'elles sont d'origine cutanée ou articulaire. La compréhe nsio n de ce rôle différentiel dans le cadre de l'I L-17A, de l'IL-17F et de l'IL-23 permet de comprendre la différence d'efficacité des inhibiteurs de ces cytokines dans le Pso, la SpA ou la PR.
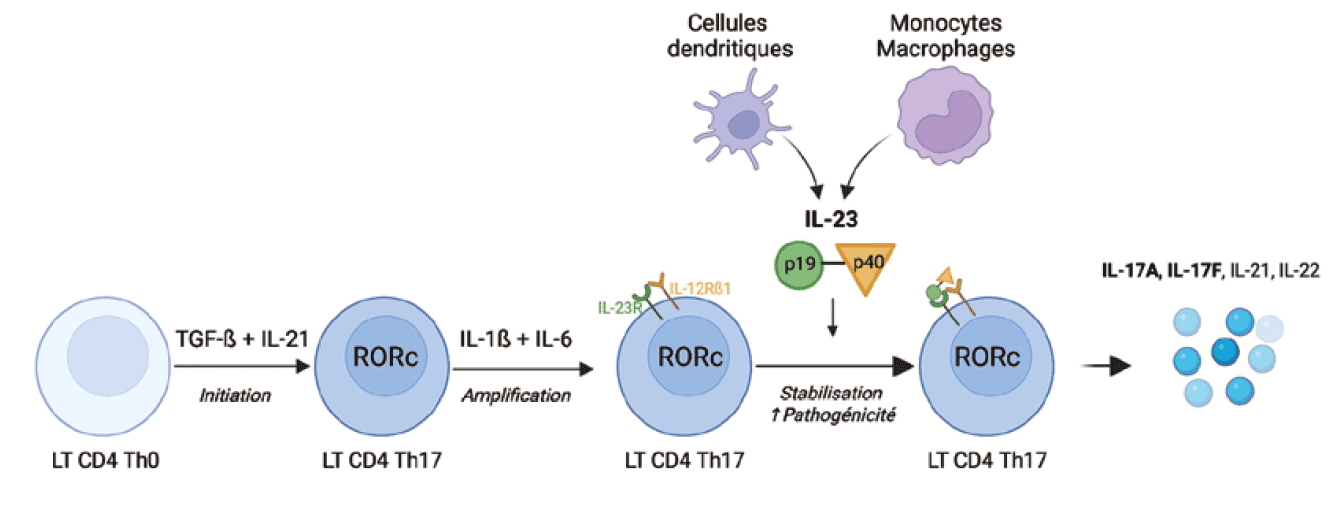
â² Figure 1 Interdépendance entre les voies de l'interleukine (IL)-17A/F et de l'IL-23 La différentiation des lymphocytes T (LT) CD4 Th17 fait intervenir une première étape sous le contrôle du TGF-ß et de l'IL-21 permettant l'expression du facteur de transcription RORc, spécifique de la lignée Th17. L'IL-1ß et l'IL-6 permettent ensuite l'expression du récepteur de l'IL-23, qui est produite par les cellules dendritiques, les monocytes et les macrophages et qui permet une stabilisation de cette différentiation vers des LT CD4 Th17 pathogènes. Ces cellules produisent ensuite l'IL-17A, l'IL-17F, l'IL-17A/F, l'IL-21 et l'IL-22. Created with BioRender.com.
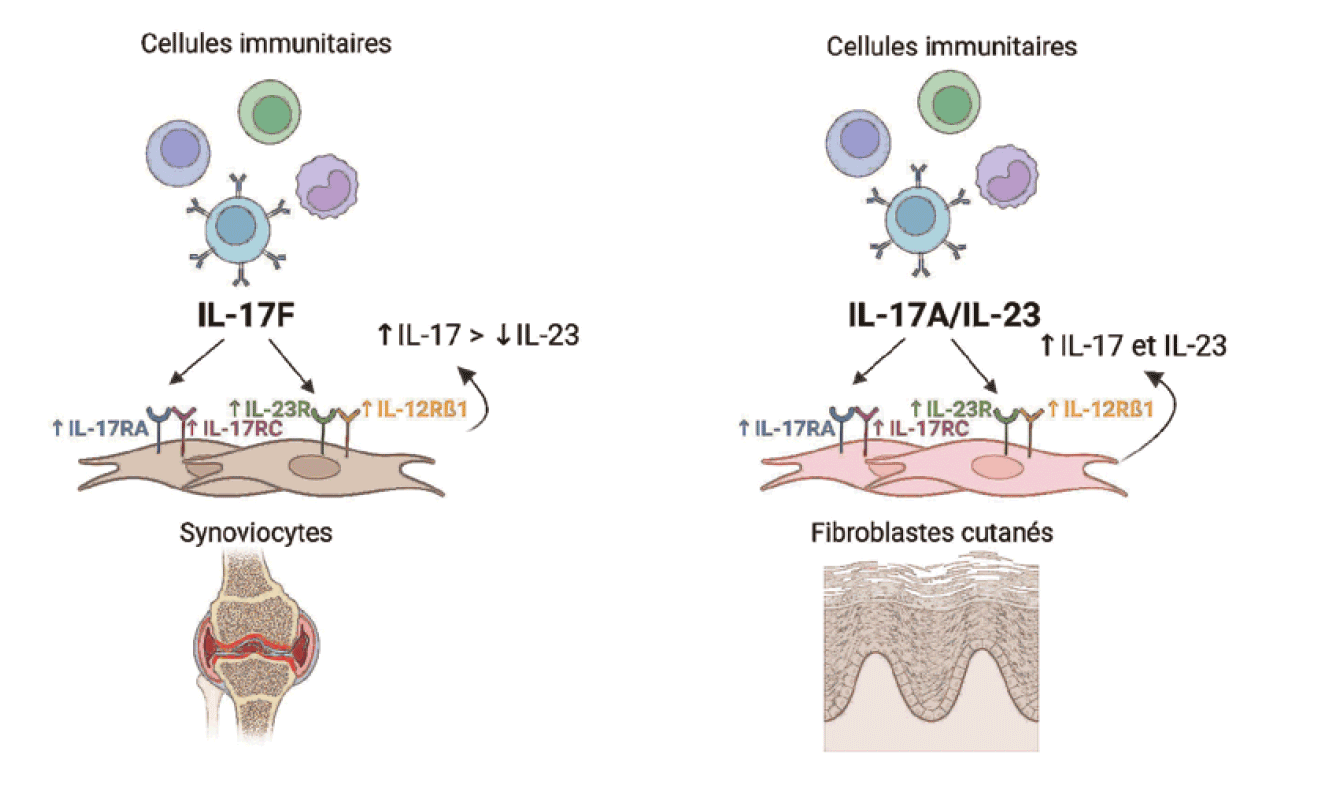
â² Figure 2 Effets tissu-dépendant de l'Interleukine (IL)-17A/F et de l'IL-23 L'IL-17A/F et de l'IL-23 se lient à leurs récepteurs : IL-17RA/IL-17RC et l'IL-23R/IL-12Rß1. L'expression de ces récepteurs est induite par l'IL-17F sur les synoviocytes, alors que ce sont l'IL-17A et l'IL-23 qui augmentent leurs expressions sur les fibroblastes cutanés. Ces cellules stromales régulent la production d'IL-17A/F et d'IL-23 dans des proportions différentes, sous-tendant l'efficacité variable des inhibiteurs de ces cytokines selon les pathologies. Created with BioRender.com.